题目内容
11.在Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2的中,Fe2O3是氧化剂,CO是还原剂,C元素被氧化,Fe元素被还原.若有1mol Fe2O3参加反应,则该反应转移6mol电子.分析 该反应中Fe元素化合价由+3价变为0价、C元素化合价由+2价变为+4价,得电子化合价降低反应物的是氧化剂,失电子化合价升高的反应物是还原剂,据此分析解答.
解答 解:在Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2的中,该反应中Fe元素化合价由+3价变为0价被还原,则Fe2O3为氧化剂;C元素化合价由+2价变为+4价被还原,则CO为还原剂;若有1mol Fe2O3参加反应转移电子为6mol;
故答案为:Fe2O3;CO;C;Fe;6.
点评 本题考查了氧化剂、还原剂的判断,根据元素化合价结合基本概念分析解答即可,知道常见元素化合价,题目难度不大.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 氯气的摩尔质量为71 | |
| B. | 将标准状况下11.2L的HCl溶于1.0L的水中,所得溶液中HCl的浓度为0.5mol/L | |
| C. | 常温常压下,等体积的CO和H2的质量比为1:1 | |
| D. | 物质的摩尔质量 (以g.mol-1为单位)在数值上等于其相对分子质量或相对原子质量 |
2.下列离子方程式中,正确的是( )
| A. | 氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O | |
| B. | 锌与盐酸的反应:Zn+2H++2Cl-═Zn2++2Cl-+H2↑ | |
| C. | 石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
19.在水溶液中能大量共存的离子组是( )
| A. | Ba2+、H+、HCO3- | B. | Cu2+、OH-、NH4+ | C. | Ag+、NO3-、Cl- | D. | Na+、NO3-、SO42- |
6.将KNO3、NaCl和沙子的混合物分开,必要的操作步骤是( )
| A. | 过滤、蒸馏、萃取 | B. | 溶解、过滤、结晶 | C. | 分液、溶液、萃取 | D. | 过滤、结晶、升华 |
16.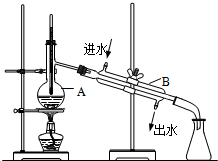 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
(1)图中有两处明显的错误是
①水银球未在蒸馏烧瓶的支管口处;
②冷却水未下进上出.
(2)A仪器的名称是圆底烧瓶,B仪器的名称是直形冷凝管.
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.(1)图中有两处明显的错误是
①水银球未在蒸馏烧瓶的支管口处;
②冷却水未下进上出.
(2)A仪器的名称是圆底烧瓶,B仪器的名称是直形冷凝管.
3.下列离子方程式书写不正确的是( )
| A. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2=SO32-+2HSO3-+H2O | |
| B. | CuCl2溶液与Na2S溶液2:1反应,Cu2++S2-=CuS↓ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| D. | 1mol/L的NaAlO2溶液和2.5mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
5.下列电离方程式中书写正确的是( )
| A. | 加热NaHSO4至熔化NaHSO4═Na++H++SO42- | |
| B. | 把CaO放入水中CaO═Ca2++O2- | |
| C. | HClO═H++ClO- | |
| D. | H2S?H++HS-;HS-?H++S2- |