题目内容
14.将CO2用碱吸收可得到重要的工业原料,若将0.2molCO2缓慢通入到100mL3mol/L的NaOH溶液中,所得溶液中含碳微粒浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),假设所得溶液的pH=a,则CO32-水解的平衡常数约为10a-14mol/L.分析 根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来分析回答;碳酸根离子水解平衡常数表达式为$\frac{[O{H}^{-}]•[HC{{O}_{3}}^{-}]}{[C{{O}_{3}}^{2-}]}$,据此分析.
解答 解:根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.2molCO2和100mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是相同浓度的碳酸钠和碳酸氢钠的混合物;混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大于碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
碳酸根离子水解平衡常数表达式为$\frac{[O{H}^{-}]•[HC{{O}_{3}}^{-}]}{[C{{O}_{3}}^{2-}]}$,pH=a,则c(OH-)=10a-14mol/L,所的溶液是相同浓度的碳酸钠和碳酸氢钠的混合物,水解都很微弱,所以碳酸根离子和碳酸氢根离子浓度大约相等,则碳酸根离子水解平衡常数为10a-14mol/L,
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);10a-14mol/L.
点评 本题考查了离子浓度大小比较和水解平衡常数的求算,注意二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,题目难度不大.

练习册系列答案
相关题目
4.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1L1 mol•L-1硫酸中所含的氧原子数为4NA | |
| B. | 标准状况下,11.2LCCl4所含的原子数为2.5NA | |
| C. | 2.3gNa中所含的电子数为1.1NA | |
| D. | 常温常压下,14g由N2与CO组成对混合气体中所含对原子数为2NA |
5.苯甲醛(微溶于水、易溶于有机溶剂,密度月等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸.反应原理如下:
2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa
C6H5CCOONa+HCl→C6H5 COOH+NaCl
相关物质物理性质如表:
实验流程如图:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出.

仪器A的名称为三颈烧瓶(或三口烧瓶),若将仪器B改为仪器C,效果不如B,说明原因:B的接触面积大,冷却回流苯甲醛的效果好
(2)操作②有关分液漏斗的使用不正确的是CD
A.分液漏斗在使用之前必须检验矢耦漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集℃的馏分.图2中有一处明显错误,正确的应改为温度计的水银球处于蒸馏烧瓶的支管口
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用滤液 冲洗杯壁上残留的晶体.抽滤完成后用少量冰水对晶体进行洗涤,洗涤应关小水龙头.
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为96.00%.
2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa
C6H5CCOONa+HCl→C6H5 COOH+NaCl
相关物质物理性质如表:
| 苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
| 沸点/℃ | 178 | 205 | 249 | 80 |
| 熔点/℃ | 26 | -15 | 122 | 5.5 |
| 苯甲酸在水中的溶解度 | ||
| 17℃ | 25℃ | 100℃ |
| 0.21g | 0.34g | 5.9g |

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出.

仪器A的名称为三颈烧瓶(或三口烧瓶),若将仪器B改为仪器C,效果不如B,说明原因:B的接触面积大,冷却回流苯甲醛的效果好
(2)操作②有关分液漏斗的使用不正确的是CD
A.分液漏斗在使用之前必须检验矢耦漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集℃的馏分.图2中有一处明显错误,正确的应改为温度计的水银球处于蒸馏烧瓶的支管口
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用滤液 冲洗杯壁上残留的晶体.抽滤完成后用少量冰水对晶体进行洗涤,洗涤应关小水龙头.
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为96.00%.
2.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,一定只生成碳酸钠、碳酸氢钠 | |
| C. | 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键 | |
| D. | CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2 |
19.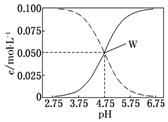 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )| A. | pH=5.75的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=7,c(Na+)=0.1 mol•L-1,c( CH3COOH)>c(Na+)=c( CH3COO-)>c(H+)=c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
6.用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是( )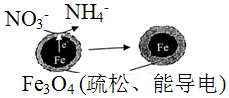

| A. | 能量转化形式主要为化学能转化为电能 | |
| B. | 电极材料分别为Fe和Fe3O4 | |
| C. | 负极反应为:NO3-+8e-+l0H+═NH4++3H2O | |
| D. | 该原理的总反应可表示为:NO3-+3Fe+2H++H2O═NH4++Fe3O4 |
3.C1O2是一种常用的气体消毒剂,能净化有毒废水中的NaCN (已知NaCN中N的化合价为-3),发生的反应为:2C1O2+2NaCN═2NaCl+2CO2+N2,下列说法正确的是( )
| A. | 反应中氯元素被氧化 | |
| B. | NaCN既是氧化剂又是还原剂 | |
| C. | 生成0.lmol N2,转移1mol电子 | |
| D. | 氧化产物与还原产物的物质的域之比为1:1 |
4.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述Ⅱ |
| A | HClO具有强氧化性 | HClO有杀菌消毒作用 |
| B | 铝比铁活泼 | 铝比铁更容易被腐蚀 |
| C | 与水反应时,钠浮在水面上 | 钠与水反应是放热反应 |
| D | 浓硝酸具有强氧化性 | 浓硝酸能和浓氨水反应产生白烟 |
| A. | A | B. | B | C. | C | D. | D |
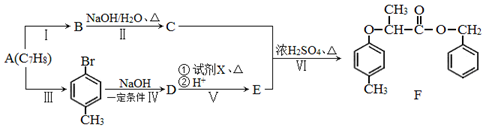
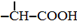 $→_{红磷、△}^{Cl_{2}}$
$→_{红磷、△}^{Cl_{2}}$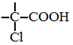
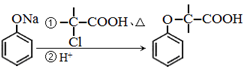
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl. .
.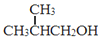 为原料制取
为原料制取 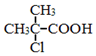 的合成路线图.
的合成路线图.