题目内容
2.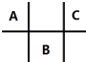 有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )| A. | 元素D形成的气态氢化物的空间结构一定是正四面体 | |
| B. | A、B 两种元素的气态氢化物均能不它们的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| C. | DB2、DC4中每个原子都满足8电子稳定结构 | |
| D. | 四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高 |
分析 由短周期元素A、B、C在周期表中所处的位置关系可知,A、C处于第二周期、B处于第三周期,A、B、C三种元素原子的质子数之和为32,令A的原子序数为x,则B的原子序数为x+8,C的原子序数为x+2,则:x+x+9+x+2=32,解得x=7,故A为氮元素、B为硫元素、C为氟元素;D元素原子的最外层电子数为次外层电子数的2倍,则D元素原子有2个电子层,最外层电子数为4,故D为碳元素,然后结合元素化合物知识来解答.
解答 解:由短周期元素A、B、C在周期表中所处的位置关系可知,A、C处于第二周期、B处于第三周期,A、B、C三种元素原子的质子数之和为32,令A的原子序数为x,则B的原子序数为x+8,C的原子序数为x+2,则:x+x+9+x+2=32,解得x=7,故A为氮元素、B为硫元素、C为氟元素;D元素原子的最外层电子数为次外层电子数的2倍,则D元素原子有2个电子层,最外层电子数为4,故D为碳元素,
A.碳元素形成的乙烯为平面结构、乙炔为直线结构,形成甲烷为正四面体,故A错误;
B.氨气与硝酸反应生成硝酸铵,硫化氢被浓硫酸氧化生成二氧化硫与水,二者反应类型不同,故B错误;
C.由C最外层电子数为4,O最外层电子为6,F最外层电子为7可知,在CO2、CF4的分子中每个原子都满足8电子稳定结构,故C正确;
D.C为氟元素,F元素非金属性最强,氢化物最稳定,故D正确;
故选CD.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子序数推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
15.化学与我们的生活息息相关.下列说法不正确的是( )
①油脂的皂化可看作取代反应
②碘盐补碘的碘是碘酸钾,AD钙奶补钙的钙是钙离子,含铁酱油补铁的铁是铁离子
③计算机芯片的硅由自然界的硅提纯而来
④棉花和合成纤维的主要成分都是纤维素
⑤生活中用的铝壶比较耐腐蚀,是因为铝是不活泼金属
⑥淀粉水解生成葡萄糖放出热量,提供生命活动的能量.
①油脂的皂化可看作取代反应
②碘盐补碘的碘是碘酸钾,AD钙奶补钙的钙是钙离子,含铁酱油补铁的铁是铁离子
③计算机芯片的硅由自然界的硅提纯而来
④棉花和合成纤维的主要成分都是纤维素
⑤生活中用的铝壶比较耐腐蚀,是因为铝是不活泼金属
⑥淀粉水解生成葡萄糖放出热量,提供生命活动的能量.
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ①③④⑥ | D. | ①②⑤⑥ |
16.下表是元素周期表的一部分,根据信息,回答下列问题:
(1)非金属性最强的元素是F(填元素符号,下同),第3周期第ⅣA族的元素是Si.
(2)CO2中存在的化学键为共价键.
(3)下列判断正确的是B
A.碱性强弱:Mg(OH)2>NaOH B.氢化物稳定性:HF>HCl
C.酸性强弱:H3PO4>H2SO4
(4)画氯离子(Cl-)的结构示意图 .
.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | C | O | F | |||||
| 3 | Na | Mg | P | S | Cl |
(2)CO2中存在的化学键为共价键.
(3)下列判断正确的是B
A.碱性强弱:Mg(OH)2>NaOH B.氢化物稳定性:HF>HCl
C.酸性强弱:H3PO4>H2SO4
(4)画氯离子(Cl-)的结构示意图
 .
.
10.短周期主族元素X、Y、Z、W的原子序数依次增大.Y原子最外层电子数是内层电子数的3倍,X与Z位于同一主族,且与Y不在同一周期,W元素的最高正化合价与最低负化合价的代数和为零,下列说法正确的是( )
| A. | Y的气态氢化物的沸点在同主族中最高,所以其气态氢化物最稳定 | |
| B. | Y、W形成的化合物与Y、Z形成的化合物中所含化学键相同 | |
| C. | 简单离子半径:Z>Y | |
| D. | 单质的氧化性:Y>W |
17.某化合物由两种单质直接反应生成,将其加(通)入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是( )
| A. | SO3 | B. | HCl | C. | FeCl2 | D. | Na2O2 |
14.下列离子方程式的书写中正确的是( )
| A. | 将少量碳酸钠溶液滴加到盐酸中 CO32-+2H +═H2O+CO2↑ | |
| B. | 向明矾中加入氢氧化钡使硫酸根完全沉淀 Ba2++SO42-═BaSO4↓ | |
| C. | 苯酚钠中通入少量CO2 C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 向石灰乳中通入过量的SO2 OH-+SO2═HSO3- |

 ),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如图2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述 CoO2的化学组成的是D.
),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如图2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述 CoO2的化学组成的是D. 在工业上有重要用途,其合成流程如图:
在工业上有重要用途,其合成流程如图:
 .
. .
. +2Ag(NH3)2OH→
+2Ag(NH3)2OH→ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.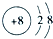 .
. .
.