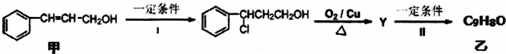
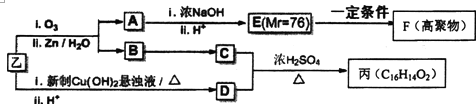
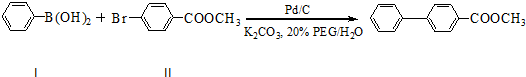题目内容
锡常用于金属的防腐镀层.25℃时,在含有Pb2+、Cu2+的某溶液 中,加入过量金属锡(Sn),发生反应:Sn(s)+Cu 2+(aq)?Sn2+(aq)+Cu (s)
(1)反应的能量变化如图.

①该反应为 反应(填“放热”或“吸热”).
②1mol Cu (s)全部氧化成Cu 2+(aq)的热化学方程式为 .
(2)测得反应体系中c(Sn2+)和c(Cu 2+)变化关系如表所示.该反应中Cu 2+平衡转化率为 .
(1)反应的能量变化如图.

①该反应为
②1mol Cu (s)全部氧化成Cu 2+(aq)的热化学方程式为
(2)测得反应体系中c(Sn2+)和c(Cu 2+)变化关系如表所示.该反应中Cu 2+平衡转化率为
| c(Sn2+) | c(Cu2+) | |
| 初始浓度 | 0.12 | C2 |
| 平衡浓度 | 0.22 | 0.1 |
考点:化学平衡的计算,热化学方程式
专题:
分析:(1)①根据图知,该反应Sn(s)+Cu 2+(aq)?Sn2+(aq)+Cu (s)是放热反应,其△H=-553.75 kJ?mol-1;②据①判断其逆反应为吸热反应;
(2)依据三段式计算即可.
(2)依据三段式计算即可.
解答:
解:(1)①根据图知,该反应Sn(s)+Cu 2+(aq)?Sn2+(aq)+Cu (s)是放热反应,其△H=-553.75 kJ?mol-1,故答案为:放热;
②根据能量守恒定律知,其逆反应是吸热反应,计量数不变,其焓变大小不变,如果有1molCu被氧化,则需要吸收553.75 kJ热量,其热化学反应方程式为Sn2+(aq)+Cu (s)=Sn(s)+Cu2+(aq)△H=+553.75 kJ?mol-1,故答案为:Sn2+(aq)+Cu (s)=Sn(s)+Cu2+(aq)△H=+553.75 kJ?mol-1;
(2)Sn(s)+Cu 2+(aq)?Sn2+(aq)+Cu (s)
初始浓度 C2 0.12
转化浓度 x x
平衡浓度 0.1 0.22
故x=0.22-0.12=0.10,故C2=0.10+0.10=0.20,故转化率为
=50%,故答案为50%.
②根据能量守恒定律知,其逆反应是吸热反应,计量数不变,其焓变大小不变,如果有1molCu被氧化,则需要吸收553.75 kJ热量,其热化学反应方程式为Sn2+(aq)+Cu (s)=Sn(s)+Cu2+(aq)△H=+553.75 kJ?mol-1,故答案为:Sn2+(aq)+Cu (s)=Sn(s)+Cu2+(aq)△H=+553.75 kJ?mol-1;
(2)Sn(s)+Cu 2+(aq)?Sn2+(aq)+Cu (s)
初始浓度 C2 0.12
转化浓度 x x
平衡浓度 0.1 0.22
故x=0.22-0.12=0.10,故C2=0.10+0.10=0.20,故转化率为
| 0.1mol/L |
| 0.2mol/L |
点评:本题主要考查的是化学平衡的计算,认真读图,从图中得出有关信息是关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A、常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、0.1mol?L-1 Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| C、0.1mol?L-1 NH4Cl溶液:c(NH4+)=c( Cl-) |
| D、向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )


| A、最高价氧化物对应水化物的酸性:Q<W |
| B、最简单气态氢化物的热稳定性:R>Q |
| C、含T的盐中,T元素只能存在于阳离子中 |
| D、原子半径:T>Q>R |
下列解释实验事实的方程式不正确的是( )
| A、可用氯气进行自来水的杀菌消毒:Cl2+H2O═HCl+HClO |
| B、将“NO2球”浸泡在热水中,颜色变深:2NO2(g)═N2O4(g)△H<0 |
| C、在刻制印刷电路板时,用FeCl3溶液腐蚀铜箔:2Fe3++3Cu═2Fe+3Cu2+ |
| D、在KNO3和稀硫酸混合液中,铜片溶解:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
水是生命之源,下列关于水的说法正确的是( )
| A、海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
| B、某温度下,pH=6的蒸馏水显酸性 |
| C、氯气有毒,因而自来水的杀菌消毒一定不能使用氯气 |
| D、明矾可用于水的净化与杀菌消毒 |