题目内容
14.下列说法正确的是( )| A. | 配制2.0 mol•L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为950 mL和201.4 g | |
| B. | 标准状况下,用3.36L HCl气体做喷泉实验完毕后,液体冲入烧瓶的一半(假设实验过程溶液无泄漏),溶液中溶质的物质的量浓度为$\frac{1}{22.4}$mol/L | |
| C. | 向0.1mol•L-1 CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 将溶质相同质量分数分别为3p%的溶液和p%的溶液等体积混合得到质量分数为q%的溶液,则p、q的关系不可能为q>2p |
分析 A.由于容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,然后根据m=cVM进行计算;
B.进入烧瓶溶液的体积等于HCl的体积,令体积为1L,根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度;
C.醋酸溶液中存在电离平衡,加水稀释促进电离,氢离子数增大,醋酸分子数减小;
D.若溶质密度大于1和密度小于1,当密度大于1,等体积混合后,浓度大的密度大,当密度小于1,浓度越大,密度越小.
解答 解:A.容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,则m(Na2CO3)=cVM=1L×2mol/L×106g/mol=212g,故A错误;
B.进入烧瓶溶液的体积等于HCl的体积,令体积为1L,HCl的物质的量=$\frac{1L}{22.4L/mol}$=$\frac{1}{22.4}$mol,溶液物质的量浓度=$\frac{\frac{1}{22.4}mol}{1L}$=$\frac{1}{22.4}$mol/L,故B正确;
C.向0.1mol•L-1 CH3COOH溶液中加入少量水,促进醋酸电离,氢离子数增多,醋酸分子数减小,$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故C错误;
D.设3p%的溶液密度为ρ1,p%的溶液密度为ρ2,体积相同为1L,得到$\frac{{ρ}_{1×1×3p%+{ρ}_{2}×1×p%}}{{ρ}_{1}×1+{ρ}_{2}×1}$=q%,若密度小于1,q<2p,若溶液密度大于1,则q>2p,故D错误;
故选B.
点评 本题考查了溶液配制、弱电解质稀释、溶液浓度计算,注意等体积不同浓度混合的溶液浓度和溶液密度有关,题目难度中等.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案| A. | ①③④ | B. | ①②③ | C. | ①②④ | D. | ②④ |
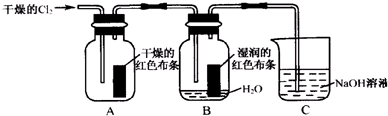
| A. | 铝制容器可盛装热的浓硫酸 | |
| B. | 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 | |
| C. | K与水反应比Li与水反应剧烈 | |
| D. | 用氢氧化钠溶液吸收二氧化氮时有一氧化氮生成 |
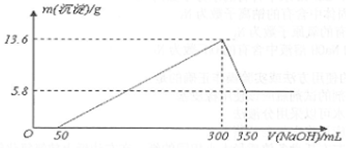
 常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )
常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )| A. | 若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{m+1}$ | |
| B. | 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH | |
| C. | 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO) | |
| D. | b~c段,随NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 |
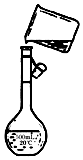 某同学用胆矾晶体(CuSO4•5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题:
某同学用胆矾晶体(CuSO4•5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题: