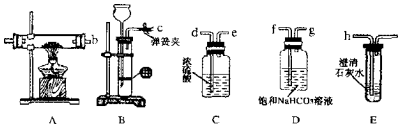
题目内容
4.为了探究HClO的漂白性,某同学设计了如下的实验: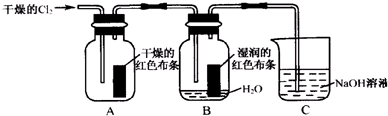
(1)通入Cl2后,集气瓶B中发生反应的化学方程式是Cl2+H2O=HCl+HClO,通过实验现象得出的结论为干燥的氯气没有漂白性,湿润的氯气具有漂白性.
(2)为了确证是HClO起漂白作用,你认为还应增加的实验是稀盐酸是否能使有色布条褪色.
(3)烧杯C中盛有NaOH溶液,其作用是吸收多余的氯气(尾气),防止氯气污染空气.
(4)为保证实验安全,当氯气以平均每分钟1.12L(标准状况)的流速通入时,若实验需耗时4分钟,则小烧杯中至少需盛有2mol•L-1NaOH溶液的体积是多少?(写出计算过程)
分析 (1)氯气能使湿润的有色布条褪色,但是不能使干燥的有色布条褪色,次氯酸具有漂白性,氯气没有漂白性;
(2)根据氯气和水反应的产物是盐酸和次氯酸,证明二者谁有漂白性即可;
(3)氯气有毒,需要用氢氧化钠来吸收;
(4)先计算出氯气的物质的量,然后根据化学方程式进行计算消耗氢氧化钠溶液的体积.
解答 解:(1)氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,原理方程式为:Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2O=HCl+HClO;干燥的氯气没有漂白性,湿润的氯气具有漂白性;
(2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,
故答案为:稀盐酸是否能使有色布条褪色;
(3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水,
故答案为:吸收多余的氯气(尾气),防止氯气污染空气;
(4)实验需耗时4分钟通入氯气的物质的量为:n(Cl2)=$\frac{1.12L×4}{22.4L/mol}$=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.4mol,
所以V(NaOH)=$\frac{0.4mol}{2mol/L}$=0.2L=200mL,
答:至少需盛200mlL 2mol•L-1的氢氧化钠溶液.
点评 本题考查了氯元素及其化合物性质、化学计算,题目难度中等,明确氯气与次氯酸的性质为解答关键,注意氯气不具有漂白性、次氯酸具有漂白性,为易错点,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 某温度下,纯水pH=6,该温度下1L pH=10的氨水中含有OH-数目为0.01NA | |
| B. | 0.1mol•L-1的AlCl3溶液与NaOH溶液反应所得产物中含Al为0.1NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24L,则参加反应的硫酸为0.4NA | |
| D. | 42gC3H6和C4H8的混合气体中含有共价键的数目为3NA |
20.下列说法正确的是( )
| A. | 干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同 | |
| B. | 化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键 | |
| C. | CH4和CCl4中,每个原子的最外层都具有8电子稳定结构 | |
| D. | NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响 |
7.某有机物含C、H、O、N四种元素,其3D模型如图所示.下列有关该有机物的说法正确的是( )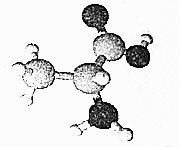

| A. | 常温常压下呈气态 | |
| B. | 分子式为C3H8O2N | |
| C. | 与H2NCH2COOH互为同系物 | |
| D. | 分子中所有C、N原子均处于同一平面 |
9.与实际化工生产流程相符的叙述是( )
| A. | 让Cl2和H2混合后,点燃生成氯化氢气体,再将氯化氢气体通入水中获得盐酸 | |
| B. | 制备硫酸,用水吸收三氧化硫气体生成浓硫酸 | |
| C. | 侯氏制碱法,将二氧化碳通入含氨的氯化钠饱和溶液中,过滤得到碳酸氢钠晶体 | |
| D. | 用电解熔融氯化铝和冰晶石的混合物的方法得到铝 |
16.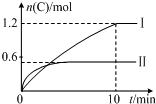 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5mol | 0.5mol | ─ |
| A. | a=-160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10min内平均速率v(B)=0.06mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率增大 |
13.将1molNaHCO3和1mol Na2O2固体混合,在加热的条件下使其充分反应,则最后所得固体为( )
| A. | 1mol Na2CO3和1mol NaOH | B. | 1mol Na2CO3和2mol NaOH | ||
| C. | 2mol Na2CO3和2mol NaOH | D. | 2mol Na2CO3 |
14.下列说法正确的是( )
| A. | 配制2.0 mol•L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为950 mL和201.4 g | |
| B. | 标准状况下,用3.36L HCl气体做喷泉实验完毕后,液体冲入烧瓶的一半(假设实验过程溶液无泄漏),溶液中溶质的物质的量浓度为$\frac{1}{22.4}$mol/L | |
| C. | 向0.1mol•L-1 CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 将溶质相同质量分数分别为3p%的溶液和p%的溶液等体积混合得到质量分数为q%的溶液,则p、q的关系不可能为q>2p |