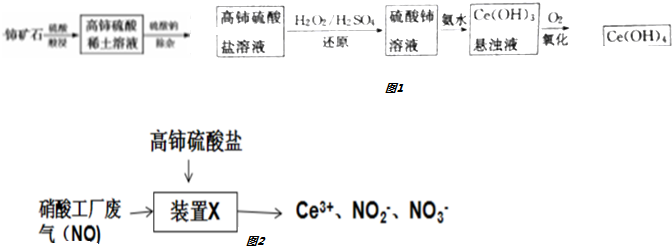
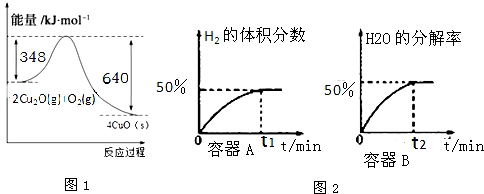
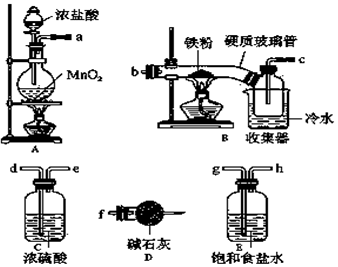
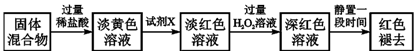
题目内容
9.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:(1))CO(g)+2H2(g)?CH3OH(g)△H1
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
(3)CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C═O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)反应①的化学平衡常数K表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$.
分析 (1)反应热=反应物总键能-生成物总键能;根据盖斯定律:反应②-反应①=反应③,反应热也进行相应的计算;
(2)反应①为CO(g)+2H2(g)?CH3OH(g),结合化学平衡常数的定义解答.
解答 解:(1)反应热=反应物总键能-生成物总键能,故△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;
根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ.mol-1-(-99kJ.mol-1)=+41kJ.mol-1,
故答案为:-99;+41;
(2)反应①为CO(g)+2H2(g)?CH3OH(g),平衡常数为K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,故答案为:K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$.
点评 本题考查化学平衡常数以及反应热有关计算,侧重考查学生分析计算能力,需要学生具备扎实的基础,注意把握化学平衡常数,难度中等.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
19.某学生用0.1000mol•L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)ABDCEF.
(2)上述B步骤操作的目的是除去附在滴定管壁上的水,防止水稀释标准溶液.
(3)实验中用左手控制活塞,眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是溶液的颜色由无色变浅红且保持半分钟内不褪色.
(4)某学生根据3次实验分别记录有关数据如表:
依据上表数据列式计算该盐酸溶液的物质的量浓度为
(5)用0.1000mol•L-1 NaOH溶液滴定0.1000mol•L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH等于10
(6)下列哪些操作会使测定结果偏高B、C、E(填序号).
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶.
A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)ABDCEF.
(2)上述B步骤操作的目的是除去附在滴定管壁上的水,防止水稀释标准溶液.
(3)实验中用左手控制活塞,眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是溶液的颜色由无色变浅红且保持半分钟内不褪色.
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测溶液的体积(mL) | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积(mL) | ||
| 第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
(5)用0.1000mol•L-1 NaOH溶液滴定0.1000mol•L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH等于10
(6)下列哪些操作会使测定结果偏高B、C、E(填序号).
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶.
18.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | 标准状况下,11.2 L NO与11.2 L O2混合所含原子数为2 NA | |
| D. | 将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
19. 如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容.据标签所提供的信息,以下说法错误的是( )
如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容.据标签所提供的信息,以下说法错误的是( )
 如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容.据标签所提供的信息,以下说法错误的是( )
如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容.据标签所提供的信息,以下说法错误的是( )| A. | 该注射液中葡萄糖的质量分数是5% | |
| B. | 葡萄糖的摩尔质量为180g•mol-1 | |
| C. | 该注射液的密度约为1g•mL-1 | |
| D. | 该注射液中葡萄糖的物质的量浓度约为0.014 mol•L-1 |