题目内容
19.下列离子方程式的书写与所给条件不相符的是( )| A. | 将Cl2通入氢氧化钠溶液制取消毒液:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 己知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O═2 Al(OH)3↓+SO32- | |
| C. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2 Al(OH)3↓ | |
| D. | 利用酸性高锰酸钾测居室中甲醛含量反应为:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O |
分析 A.氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
B.亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)要大,说明酸性:亚硫酸>氢氧化铝;
C.明矾溶液中加入氢氧化钡溶液至沉淀的质量最大时,硫酸钡完全沉淀,此时,铝离子完全变为偏铝酸根;
D.酸性高锰酸钾氧化甲醛生成二氧化碳本身被还原为二价锰离子.
解答 解:A.氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:C12+2OH-═Cl-+ClO-+H2O,故A正确;
B.亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)要大,说明酸性:亚硫酸>氢氧化铝,所以2AlO2-+SO2+3H2O→2Al(OH)3↓+SO32-,符合强酸制弱酸的原则,故B正确;
C.明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+[Al(OH)4]-↓,故C错误;
D.酸性高锰酸钾与甲醛反应离子方程式:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O,故D正确;
故选:C.
点评 本题考查学生离子方程式书写的正误判断知识,明确反应实质及离子方程式书写方法是解题关键,注意强酸制备弱酸规律,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性.
回答下列问题:
(1)元素x在周期表中的位置是第三周期第ⅡA族,其单质可采用电解熔融MgCl2的方法制备.
(2)气体分子(mn)2的电子式为 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2═4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]═Na++[Au(CN)2]-
然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4].据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:O2+2H2O+4e-═4OH-,负极:Au+2CN--e-═[Au(CN)2]-.
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色.写出解毒原理的相关离子方程式S2O32-+CN-═SCN-+SO32-.
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是第三周期第ⅡA族,其单质可采用电解熔融MgCl2的方法制备.
(2)气体分子(mn)2的电子式为
 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2═4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]═Na++[Au(CN)2]-
然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4].据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:O2+2H2O+4e-═4OH-,负极:Au+2CN--e-═[Au(CN)2]-.
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色.写出解毒原理的相关离子方程式S2O32-+CN-═SCN-+SO32-.
4.下列鉴别方法不可行的是( )
| A. | 仅用氨水即可鉴别NaCl、AgCl3、AgNO3 | |
| B. | 用水鉴别乙醇、甲苯、苯 | |
| C. | 用新制氢氧化铜悬浊液鉴别甲酸、乙酸、乙醛 | |
| D. | 用激光笔照射的方法鉴别硫酸铜溶液和氢氧化铁胶体 |
11.现有部分短周期元素的性质或原子结构如表:
(1)元素T在周期表中的位置是三周期ⅥA族.
(2)元素X的一种同位素可测定文物年代,这种同位素的符号是14C.
(3)元素Y与氢元素形成一种分子YH3,写出该粒子的化学式:NH3.
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)T、X、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3(用化学式表示).
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素X的一种同位素可测定文物年代,这种同位素的符号是14C.
(3)元素Y与氢元素形成一种分子YH3,写出该粒子的化学式:NH3.
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)T、X、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3(用化学式表示).
8.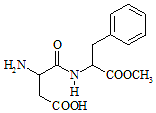 阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
 阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )| A. | 分子式为C14H18N2O3,阿斯巴甜不属于蛋白质 | |
| B. | 阿斯巴甜的水解产物中只有一种氨基酸 | |
| C. | 阿斯巴甜在一定条件下不能与酸反应、只能与碱反应 | |
| D. | 阿斯巴甜分子中有3个手性碳原子 |
4.下列关于化学实验的一些说法正确的是( )
| A. | 容量瓶不可以用来溶解固体,但可以用来稀释浓的溶液 | |
| B. | 粗盐提纯时过滤所用普通漏斗与萃取所用分液漏斗结构是一样的 | |
| C. | 用50mL量筒可准确配制50mL0.10mol/L的碳酸钠溶液 | |
| D. | 实验室制蒸馏水时冷凝管要“下进水、上出水”并保还水的持续流动 |
 实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题: