题目内容
11.现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素X的一种同位素可测定文物年代,这种同位素的符号是14C.
(3)元素Y与氢元素形成一种分子YH3,写出该粒子的化学式:NH3.
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)T、X、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3(用化学式表示).
分析 T的M层上的电子数是原子核外电子层数的2倍,T为S元素;X的最外层电子数是次外层电子数的2倍,可知X为C元素;Y的常温下单质为双原子分子,其氢化物水溶液呈碱性,Y为N元素,Z元素最高正价是+7价,可知Z为Cl,以此来解答.
解答 解:由上述分析可知,T为S,X为C,Y为N,Z为Cl,则
(1)元素T在周期表中的位置是三周期ⅥA族,故答案为:三;ⅥA;
(2)元素X的一种同位素可测定文物年代,这种同位素的符号是14C,故答案为:14C;
(3)元素Y与氢元素形成一种分子YH3,写出该粒子的化学式为NH3,故答案为:NH3;
(4)元素Z与元素T相比,非金属性较强的是Cl,可利用氢化物的稳定性比较,非金属性与单质状态、与氢氧化钠溶液反应无关,故答案为:Cl;b;
(5)非金属性Cl>S>C,则T、X、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3,故答案为:HClO4>H2SO4>H2CO3.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的性质、元素化合物知识来推断为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
2.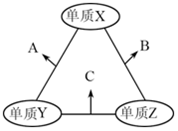 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )| A. | 元素X,Z的单质均存在同素异形体 | B. | A和C溶于水,溶液均显碱性 | ||
| C. | A和B都可能具有漂白性 | D. | Z的氧化物的水化物一定是强酸 |
19.下列离子方程式的书写与所给条件不相符的是( )
| A. | 将Cl2通入氢氧化钠溶液制取消毒液:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 己知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O═2 Al(OH)3↓+SO32- | |
| C. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2 Al(OH)3↓ | |
| D. | 利用酸性高锰酸钾测居室中甲醛含量反应为:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O |
6. 向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
 向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )| A. | x可能等于2也可能等于3 | |
| B. | 若向平衡后的乙容器中充入C,则再次达到平衡时A 的体积分数不变 | |
| C. | 单独升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同 | |
| D. | 若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol•L-1<c(A)<0.5mol•L-1 |
16.下列变化需克服相同类型作用力的是( )
| A. | 碘和干冰的升华 | B. | 硅和C60的熔化 | ||
| C. | 氯化氢和氯化钠的溶解 | D. | 液溴和液汞的汽化 |
3.下列叙述中正确的是( )
| A. | 金属的熔点和沸点都很高 | B. | CCl4是含有极性键的非极性分子 | ||
| C. | HF、HCl、HBr、HI的稳定性依次增强 | D. | 第一电离能N<O |
20.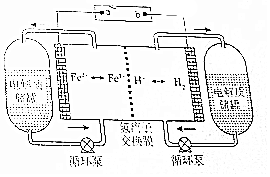 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )| A. | 充电时,a连接直流电源的正极 | |
| B. | 充电时,阴极的电极反应式为2Fe3++2e-═2Fe2+ | |
| C. | 放电时,右侧电解质储罐中的SO42-浓度逐渐增加 | |
| D. | 放电时,当转移0.1mol e-时,透过交换膜的离子有0.2mol |
16.可逆反应:3A(g)?3B(?)+C(?);△H>0,升高温度,气体的平均相对分子质量变小,则下列判断正确的是( )
| A. | B和C一定都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B和C不可能都是气体 |