题目内容
7.下列物质在溶液中电离出的Cl-与1mol CaCl2电离出的Cl-数目相同的是( )| A. | 2mol KClO3 | B. | 1mol KCl | C. | 1mol Ca(ClO)2 | D. | 2mol NaCl |
分析 离子的物质的量与溶质的化学式有关,氯离子的物质的量=溶质物质的量×化学式中氯离子个数.
解答 解:1mol CaCl2电离出的Cl-物质的量2mol,
A.KClO3 中不存在氯离子,故A错误;
B.1mol KCl中含氯离子1mol,故B错误;
C.1mol Ca(ClO)2 溶液中不存在氯离子,故C错误;
D.2mol NaCl溶液中存在氯离子2mol,故D正确;
故选D.
点评 本题考查了溶液中离子浓度的计算,明确溶液中离子的浓度=溶液的浓度×化学式中离子个数是解本题的关键,难度不大.

练习册系列答案
相关题目
17. 碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
(1)某学生的实验流程如下:

①称量用的仪器是托盘天平,最小量度单位0.1g.
②如图为灼烧装置.下列对应仪器的名称中,若正确的在后面横线上写上“正确”,若错误请将正确名称写在后面横线上.
a.坩锅正确 b.三脚架泥三角
③流程中“操作”是指冷却,这一操作必须放在干燥器(填仪器名称)中进行.
④该学生停止实验的依据为连续两次称量的质量差不超过0.1g.
⑤实验结果记录如下:容器质量为33.6g
根据上表数据推算出n值,n=10.
(2)另有学生测定结果n值偏小,其可能的原因为b、c.
a.温度过高致少量碳酸钠分解了 b.碳酸钠晶体样品已有少量风化
c.碳酸钠晶体样品没有完全失去结晶水 d.加热过程中有少量晶体溅出.
 碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.(1)某学生的实验流程如下:

①称量用的仪器是托盘天平,最小量度单位0.1g.
②如图为灼烧装置.下列对应仪器的名称中,若正确的在后面横线上写上“正确”,若错误请将正确名称写在后面横线上.
a.坩锅正确 b.三脚架泥三角
③流程中“操作”是指冷却,这一操作必须放在干燥器(填仪器名称)中进行.
④该学生停止实验的依据为连续两次称量的质量差不超过0.1g.
⑤实验结果记录如下:容器质量为33.6g
| 称量次序 | 加热温度(℃) | 容器+试样质量(g) |
| Ⅰ | 常温 | 62.2 |
| Ⅱ | T1 | 56.8 |
| Ⅲ | T2 | 49.6 |
| Ⅳ | T3 | 44.2 |
| Ⅴ | T4 | 44.2 |
(2)另有学生测定结果n值偏小,其可能的原因为b、c.
a.温度过高致少量碳酸钠分解了 b.碳酸钠晶体样品已有少量风化
c.碳酸钠晶体样品没有完全失去结晶水 d.加热过程中有少量晶体溅出.
18.天津市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
1KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验,向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(3)已知:I2+2S2O32-═2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验,向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(3)已知:I2+2S2O32-═2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
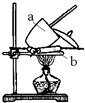
15.如图所示,甲池的总反应式O2+N2H4═2H2O+N2.有关该装置工作时,说法正确的是( )
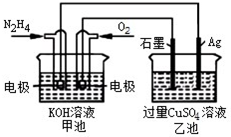

| A. | 甲池中,负极反应为N2H4-4e-═4H++N2 | |
| B. | 甲池溶液pH 保持不变,乙池溶液pH 减小 | |
| C. | 甲池中消耗2.24LO2,此时乙池中理论上多产生12.8g 固体 | |
| D. | 反应一段时间后,向乙池中加一定量CuO 固体,能使CuSO4溶液恢复到原浓度 |
8.如图曲线的变化趋势完全正确的一组是( )
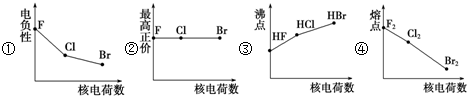

| A. | ①②③④ | B. | ②③④ | C. | ① | D. | ①②③ |
5.下列解释事实的离子方程式不正确的是( )
| A. | 粗铜精炼时,阴极质量增加:Cu2++2e-═Cu | |
| B. | 明矾可用作净水剂:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | 用食醋除去水壶中的水垢(CaCO3):2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2(s)?Mg2+(aq)+2OH- (aq) |
6.下列离子在溶液中能常量共存的是( )
| A. | K+ H+ Fe2+ NO3- | B. | H+ Al3+ SO42- Cl- | ||
| C. | Na+ Al3+ HCO3- Cl- | D. | Na+ NH4+ OH- CO32- |
