题目内容
7.某研究性学习小组对苹果“生锈”(新切开的苹果表面颜色逐渐变深)的原因进行探讨(注:题中所述颜色变化均已做过对比实验,不会因试剂本身而产生干扰).鲜苹果中营养物质的含量(mg/100g):蛋白质200-400,铁0.1-0.3,总糖1300-1500,并含有多酚及黄酮类天然化学抗氧化物质.
苹果“生锈”的可能原因:
假设1:由所含铁元素被氧化生成铁的氧化物或氢氧化物而形成;
假设2:由所含多酚被氧化而形成:
假设3:可能由所含铁元素和所含多酚被氧化共同形成.
取所得苹果汁进行以下实验:
(1)经测定,鲜苹果汁的pH为3.48.
(2)观察,苹果汁呈黄色,加入少许某不能与盐酸反应的黑色颗粒,果汁的颜色明显变浅.将果汁分为4份分别进行下列实验.
(3)第一份滴加少许KSCN溶液,未见红色,加入适量H2O2,仍未见红色,充分加热,液体的颜色反而变为无色,同时有气泡产生,再滴入少许FeCl2溶液,液体变为红色.
(4)第二份滴加足量溴水,有少量沉淀生成,静置后,倾出上层液体,固体经洗涤后成白色,在倾出的上层液体中滴加少许KSCN溶液,也未见红色,再滴入少许CCl4充分振荡后,静置,下层液体呈棕黄色.
(5)第三份加入少许稀HNO3,充分加热,试管中出现红棕色气体,液体的颜色明显变深,放置一段时间后,液体的颜色逐渐变浅,但仍比加入HNO3前深,再滴加少许KSCN溶液,液体变为红色.
(6)配制相同体积的与(5)中放置一段时间后的液体颜色相近的FeCl3溶液,滴加与(5)中等量的KSCN溶液,溶液的红色比(5)中明显深许多.另取一只苹果,灼烧成灰,加入稀HCl充分搅拌后,取所得液体,滴入KSCN溶液,液体变为红色.
完成下列问题:
(1)假设3:可能由所含铁元素和所含多酚被氧化共同形成;
(2)完成操作1所用仪器的名称是研钵,经操作2后,所得苹果汁仍很浑浊,所作的处理是重复过滤,测定鲜苹果汁pH时所用的仪器或用品是pH计;
(3)处理苹果汁时所加的黑色颗粒可能是活性炭;
(4)实验(3)体现了H2O2的哪些性质(要求写两点)强氧化性(或漂白性)、不稳定性;
(5)通过实验(4)可推测,苹果中含有哪类物质多酚;实验中设置加入CCl4的目的是证明加入的Br2已经足量;
(6)对比实验(3)和实验(5),你能得出的结论是硝酸的氧化性强于过氧化氢;对比实验(5)和实验(6),说明苹果汁中所含的营养物质是蛋白质;
(7)实验(5)中试管中出现红棕色气体的可能原因是(要求写两点)硝酸分解生成二氧化氮、稀硝酸被苹果中还原性物质还原为NO,NO与氧气反应生成二氧化氮;
(8)通过实验,你认为苹果中的“铁”以何种形式存在与有机物结合在一起.
分析 (1)根据假设1、2可知,可能由所含铁元素和所含多酚被氧化共同形成;
(2)操作1是将固体研碎,需要用到研钵;操作2是将不同的固体与液体分离,应采取过滤操作,过滤后的滤液浑浊需要重复过滤;测定鲜苹果汁的pH为3.48,所用的仪器或用品是pH计;
(3)加入少许某不能与盐酸反应的黑色颗粒,果汁的颜色明显变浅,该黑色物质具有吸附有色物质;
(4)实验(3)中加入少许KSCN溶液,未见红色,苹果汁中没有Fe3+,再加入适量H2O2,仍未见红色,充分加热,液体的颜色反而变为无色,同时有气泡产生,过氧化氢有强氧化性,将有色物质氧化为无色物质,同时过氧化氢不稳定,可以分解生成水与氧气.再滴入少许FeCl2溶液,液体变为红色,Fe2+被过氧化氢氧化为Fe3+,对比说明苹果汁中没有Fe2+;
(5)实验(4)第二份滴加足量溴水,得到白色沉淀,说明苹果汁中含有多酚类物质,上层液体中滴加少许KSCN溶液,也未见红色,说明苹果汁中没有Fe3+,滴入少许CCl4萃取溶液中的溴,证明溴水足量;
(6)实验(5)中第三份加入少许稀HNO3,充分加热,放置一段时间后,液体的颜色逐渐变浅,但仍比加入HNO3前深,再滴加少许KSCN溶液,液体变为红色,溶液中含有Fe3+,说明硝酸可以将苹果中的“Fe”氧化为Fe3+,与(3)中实验相比,过氧化氢不能将苹果中的“Fe”氧化为Fe3+;
加入的少许硝酸先将苹果中的“Fe”氧化为Fe3+,而后Fe3+又氧化多酚等物质,液体的颜色逐渐变浅,结合实验(6)中可知,苹果中Fe与有机物结合在一起,而糖只含有C、H、O三种元素,可以说明营养物质是蛋白质;
(7)第三份加入少许稀HNO3,充分加热,试管中出现红棕色气体,该红棕色气体为二氧化氮,可能是硝酸分解生成二氧化氮,也可能是稀硝酸苹果中还原性物质还原为NO,NO与氧气反应生成二氧化氮;
(8)由上述分析可知,苹果汁中没有Fe2、Fe3+,则另取一只苹果,灼烧成灰,加入稀HCl充分搅拌后,取所得液体,滴入KSCN溶液,液体变为红色,说明所得溶液中含有Fe3+,可知苹果中“Fe”与有机物结合在一起.
解答 解:(1)根据假设1、2可知,假设3应为:可能由所含铁元素和所含多酚被氧化共同形成,故答案为:可能由所含铁元素和所含多酚被氧化共同形成;
(2)操作1是将固体研碎,需要用到研钵;操作2是将不同的固体与液体分离,应采取过滤操作,所得苹果汁仍很浑浊,需要重复过滤;测定鲜苹果汁的pH为3.48,所用的仪器或用品是pH计,故答案为:研钵;重复过滤;pH计;
(3)苹果汁呈黄色,加入少许某不能与盐酸反应的黑色颗粒,果汁的颜色明显变浅,该黑色物质具有吸附有色物质,可能为活性炭,故答案为:活性炭;
(4)实验(3)中加入少许KSCN溶液,未见红色,苹果汁中没有Fe3+,再加入适量H2O2,仍未见红色,充分加热,液体的颜色反而变为无色,同时有气泡产生,再滴入少许FeCl2溶液,液体变为红色,Fe2+被过氧化氢氧化为Fe3+,对比说明苹果汁中没有Fe2+,过氧化氢有强氧化性,将有色物质氧化为无色物质,液体的颜色反而变为无色,同时过氧化氢不稳定,可以分解生成水与氧气,体现了H2O2:强氧化性(或漂白性)、不稳定性;故答案为:强氧化性(或漂白性);不稳定性;
(5)实验(4)第二份滴加足量溴水,有少量沉淀生成,静置后,倾出上层液体,固体经洗涤后成白色,说明苹果汁中含有多酚类物质,在倾出的上层液体中滴加少许KSCN溶液,也未见红色,苹果汁中没有Fe3+,再滴入少许CCl4充分振荡后,静置,下层液体呈棕黄色,萃取溶液中的溴,证明加入的溴水是过量的,进一步说明苹果汁中没有Fe3+,故答案为:多酚;证明加入的Br2已经足量;
(6)实验(5)中第三份加入少许稀HNO3,充分加热,放置一段时间后,液体的颜色逐渐变浅,但仍比加入HNO3前深,再滴加少许KSCN溶液,液体变为红色,溶液中含有Fe3+,说明硝酸可以将苹果中的“Fe”氧化为Fe3+,与(3)中实验相比,过氧化氢不能将苹果中的“Fe”氧化为Fe3+,说明硝酸的氧化性强于过氧化氢;
加入的少许硝酸先将苹果中的“Fe”氧化为Fe3+,而后Fe3+又氧化多酚等物质,液体的颜色逐渐变浅,结合实验(6)中可知,苹果中Fe与有机物结合在一起,而糖只含有C、H、O三种元素,可以说明营养物质是蛋白质;故答案为:硝酸的氧化性强于过氧化氢;蛋白质;
(7)第三份加入少许稀HNO3,充分加热,试管中出现红棕色气体,该红棕色气体为二氧化氮,可能是硝酸分解生成二氧化氮,也可能是稀硝酸被苹果中还原性物质还原为NO,NO与氧气反应生成二氧化氮,故答案为:硝酸分解生成二氧化氮;稀硝酸被苹果中还原性物质还原为NO,NO与氧气反应生成二氧化氮;
(8)由上述分析可知,苹果汁中没有Fe2、Fe3+,则另取一只苹果,灼烧成灰,加入稀HCl充分搅拌后,取所得液体,滴入KSCN溶液,液体变为红色,说明所得溶液中含有Fe3+,可知苹果中“Fe”与有机物结合在一起,故答案为:与有机物结合在一起.
点评 本题考查探究实验、实验方案的评价等,侧重考查学生分析推理能力,是对学生综合能力的考查,难度较大.

| A. | 实验中玻璃棒的作用是加速固体溶解 | |
| B. | 玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 | |
| C. | 反应中断开化学键吸收的总能量低于形成化学键放出的总能量 | |
| D. | 该反应中,反应物的总能量小于生成物的总能量 |
| A. | 甲醛溶液 | B. | 酒精 | C. | 饱和(NH4)2SO4溶液 | D. | 醋酸铅溶液 |
| A. | 铝常温下不与氧气反应 | |
| B. | 铝常温下不与浓硫酸反应产生气体,是因为发生钝化 | |
| C. | 向氯化铝溶液中逐滴加入氨水的现象是先产生白色沉淀,后白色沉淀又溶解 | |
| D. | 氧化铝只能与酸反应,不能与碱反应 |
| A. | 加入少量浓盐酸 | B. | 加入几滴氯化铜溶液 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |
| A. | 原子晶体 | B. | 非极性分子型物质 | ||
| C. | 极性分子型物质 | D. | 离子晶体 |
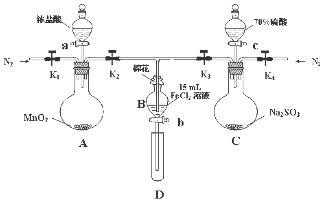 为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中继续通入N2,然后关闭K1、K3、K4
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
IV.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰.
(2)棉花中浸润的溶液化学式为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为KSCN溶液和铁氰化钾(或K3[FeCN6])溶液.若确定有Fe3+ 和Fe2+,则现象分别是溶液变红和产生蓝色沉淀.
(5)过程Ⅵ,检验B溶液中含有SO42-的操作是.
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是乙、丙(填“甲”“乙”“丙”).
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
 常温下,现有浓度都为0.1mol•L-1HX、HY的溶液各20ml,分别用0.1mol•L-1NaOH溶液滴定.溶液的pH与加入NaOH溶液体积V的关系如图所示.
常温下,现有浓度都为0.1mol•L-1HX、HY的溶液各20ml,分别用0.1mol•L-1NaOH溶液滴定.溶液的pH与加入NaOH溶液体积V的关系如图所示.下列判断错误的是( )
| A. | 滴定过程中,水电离的c(H+)•c(OH-)均不变 | |
| B. | HX的电离程度小于HY的电离程度 | |
| C. | V=10ml时,c(HX)+c(X-)=2c(Na+) | |
| D. | V=20ml时,c(Y-)>c(X-) |
