题目内容
9.黄铜矿(主要成分为CuFeS2,化学式的式量为184,S的化合价为-2价)是工业炼铜的主要原料,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,设计了如下实验:
现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,发生如下反应:3CuFeS2+8O2$\frac{\underline{\;高温\;}}{\;}$ 3Cu+Fe3O4+6SO2,实验后取d中溶液的置于锥形瓶中(假设生成的气体全部进入d并全部被水吸收),用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL.请回答下列问题:
(1)反应中氧化产物是Fe3O4;SO2.
(2)实验中需要将固体样品研细,研磨中需要的仪器是研钵;装置c的作用是除去反应多余的氧气.
(3)用标准碘溶液滴定d中溶液的离子方程式是I2+SO2+2H2O=4H++SO42-+2I-,滴定达终点时的现象是溶液由无色变为蓝色且保持30s不变.
(4)上述反应结束后,仍需通一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确.
(5)通过计算可知,该黄铜矿的纯度为50%.
(6)若将原装置d中的试液换为Ba(OH)2溶液,测得黄铜矿纯度偏高,假设实验操作均正确,可能的原因主要是空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.
分析 该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度,
(1)依据化学方程式中元素化合价变化分析,元素化合价升高的得到氧化产物,
(2)研磨固体要在研钵中进行,装置c中灼热的铜网能与空气中的氧气反应,吸收未反应的氧气;
(3)d中溶液中溶解有二氧化硫,用标准碘溶液滴定d中溶液,碘与二氧化硫反应生成硫酸根离子和碘离子;用淀粉作指示剂时,滴定达终点时溶液出现蓝色;
(4)为了使生成的二氧化硫被充分吸收,结束后仍需通一段时间的空气;
(5)二氧化硫和单质碘之间发生氧化还原反应,根据消耗碘单质的量可以确定二氧化硫的量,进而确定黄铜矿的纯度;
(6)二氧化碳和二氧化硫均可以和氢氧化钡反应生成白色沉淀,亚硫酸钡易被氧化为硫酸钡,据此分析;
解答 解:该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度,
(1)根据反应3CuFeS2+8O2$\frac{\underline{\;高温\;}}{\;}$ 3Cu+Fe3O4+6SO2,反应铁元素从+2价变为+3价,硫从-2价变为+4价,所以反应中氧化产物为Fe3O4、SO2,
故答案为:Fe3O4、SO2;
(2)研磨固体要在研钵中进行,装置c中灼热的铜网能与空气中的氧气反应,吸收未反应的氧气,
故答案为:研钵;除去反应多余的氧气;
(3)d中溶液中溶解有二氧化硫,用标准碘溶液滴定d中溶液,碘与二氧化硫反应生成硫酸根离子和碘离子,反应的离子方程式为I2+SO2+2H2O=4H++SO42-+2I-,用淀粉作指示剂时,滴定达终点时溶液由无色变为蓝色且保持30s不变,
故答案为:I2+SO2+2H2O=4H++SO42-+2I-;溶液由无色变为蓝色且保持30s不变;
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:$\frac{0.92g}{1.84g}$×100%=50%,故答案为:50%;
(6)空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.
点评 本题考查了探究黄铜矿的纯度,涉及了仪器选择、纯度计算等知识,题量较大,充分考查了学生分析和解决问题的能力,本题难度较大.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案C3H3N+C4H6+C8H8$\stackrel{一定条件}{→}$CaHbNc(未配平)
丙烯腈 1,3-丁二烯 苯乙烯 ABS
则参加反应的原料中丙烯腈和1,3-丁二烯的分子个数之比为( )
| A. | $\frac{2c}{b-a}$ | B. | $\frac{b}{2(c-a)}$ | C. | $\frac{c-a}{b-a}$ | D. | 无法确定 |

| A. | 每生成2molAB吸收b kJ热量 | |
| B. | 该反应热△H=(b-a)kJ•mol-1 | |
| C. | 该反应为吸热反应 | |
| D. | 断裂1 mol A-A和1 mol B-B键放出a kJ能量 |
| A. | 某无色溶液可大量存在:H+、Cl-、MnO4- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中可能存在:K+、Na+、[Al(OH)4]-、CO32- | |
| C. | 与Al反应能放出H2的溶液中可大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 氢氧化钙溶液中可大量存在:Na+、ClO-、HCO3- |
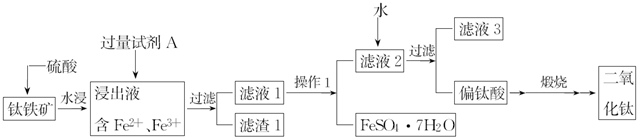
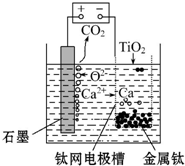

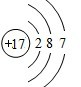 ,C元素离子电子式Na+.
,C元素离子电子式Na+. .
.