题目内容
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式 .
(2)2Zn(s)+O2(g)=2ZnO(s)△H1=-702kJ/mol
2Hg(l)+O2(g)=2HgO(s)△H2=-182kJ/mol
由此可知ZnO(s)+Hg(l)=Zn(s)+HgO(s)△H3= .
(2)2Zn(s)+O2(g)=2ZnO(s)△H1=-702kJ/mol
2Hg(l)+O2(g)=2HgO(s)△H2=-182kJ/mol
由此可知ZnO(s)+Hg(l)=Zn(s)+HgO(s)△H3=
考点:有关反应热的计算,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据概念书写热化学方程式,标注物质聚集状态和对应焓变;
(2)根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
(2)根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
解答:
解:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据概念书写热化学方程式,标注物质聚集状态和对应焓变,在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,1mol甲烷燃烧生成稳定氧化物放热880KJ,表示甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880 kJ/mol;故答案为:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880 kJ/mol;
(2)已知①2Zn(s)+O2(g)=2ZnO(s)△H1=-702kJ/mol
②2Hg(l)+O2(g)=2HgO(s)△H2=-182kJ/mol
根据盖斯定律,
(①-②)得Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H3=
(△H1-△H2)=
(-702kJ/mol+182kJ/mol)=-260kJ/mol,
故答案为:-260kJ/mol.
(2)已知①2Zn(s)+O2(g)=2ZnO(s)△H1=-702kJ/mol
②2Hg(l)+O2(g)=2HgO(s)△H2=-182kJ/mol
根据盖斯定律,
| 1 |
| 2 |
则△H3=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-260kJ/mol.
点评:本题考查燃烧热的含义、盖斯定律、反应热的计算等,难度中等,注意盖斯定律的理解与运用.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目
SO2的回收利用方案如图所示.下列说法错误的是( )
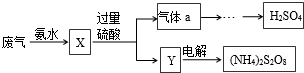

| A、X可能含有2种盐 |
| B、a是SO3 |
| C、Y中含NH4HSO4 |
| D、(NH4)2S2O8中S的化合价不可能为+7 |
将贮满某种干燥气体的试管倒置于水中,轻轻摇晃后,水可以充满试管.该气体可能是( )
| A、O2 |
| B、N2 |
| C、H2 |
| D、NH3 |
下列有关常见有机物的叙述正确的是( )
| A、乙醇在一定条件下可以转化成乙醛、乙酸乙酯或CO2 |
| B、(NH4)2SO4溶液、CuSO4溶液和福尔马林都可使蛋白质变性 |
| C、乙烯和苯都能使酸性KMnO4溶液褪色 |
| D、煤的干馏、油脂的皂化和石油的分馏都属于化学变化 |
下列关于有机物的说法正确的是( )
| A、淀粉、油脂、蛋白质均为天然高分子化合物 |
| B、葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体 |
| C、羊毛、棉花、蚕丝、麻都是天然纤维 |
| D、1mol蔗糖完全水解可生成2mol葡萄糖 |
 磺化煤(表达式为NaR)是一种钠离子型离子交换剂,它能与硬水中的Ca2+、Mg2+交换而将其除去,从而使水软化.现代海水的淡化方法是使海水按顺序通过两种离子交换剂,其流程如图所示.
磺化煤(表达式为NaR)是一种钠离子型离子交换剂,它能与硬水中的Ca2+、Mg2+交换而将其除去,从而使水软化.现代海水的淡化方法是使海水按顺序通过两种离子交换剂,其流程如图所示.