题目内容
SO2的回收利用方案如图所示.下列说法错误的是( )
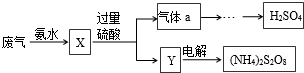

| A、X可能含有2种盐 |
| B、a是SO3 |
| C、Y中含NH4HSO4 |
| D、(NH4)2S2O8中S的化合价不可能为+7 |
考点:二氧化硫的化学性质
专题:元素及其化合物
分析:由流程可知,氨水与废气反应生成亚硫酸氨或亚硫酸氢铵,然后与过量硫酸反应生成气体a为二氧化硫,Y为硫酸铵、硫酸氢铵,以此来解答.
解答:
解:A.废气少量时生成X为亚硫酸铵,废气过量时生成X为亚硫酸氢铵,或二者均有,故A正确;
B.亚硫酸氨或亚硫酸氢铵,与过量硫酸反应生成气体a为二氧化硫,故B错误;
C.因硫酸过量,则X与硫酸反应产物Y中含NH4HSO4,故C正确;
D.(NH4)2S2O8中为连二硫酸铵,S最外层有6个电子,最高价为+6价,则S的化合价不可能为+7,故D正确;
故选B.
B.亚硫酸氨或亚硫酸氢铵,与过量硫酸反应生成气体a为二氧化硫,故B错误;
C.因硫酸过量,则X与硫酸反应产物Y中含NH4HSO4,故C正确;
D.(NH4)2S2O8中为连二硫酸铵,S最外层有6个电子,最高价为+6价,则S的化合价不可能为+7,故D正确;
故选B.
点评:本题考查二氧化硫的化学性质及物质分离等,为高频考点,把握物质的量的多少对反应的影响及发生的化学反应为解答的关键,选项D为解答的难点,题目难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
对于N2(g)+3H2(g)?2NH3(g),不能作为反应达到平衡状态的判断依据是( )
| A、N2、H2、NH3的浓度不再发生变化 |
| B、恒容密闭容器中总压强不变 |
| C、生成氨气的速率与氨气分解的速率相等 |
| D、单位时间内生成1molN2,同时生成3molH2 |
反应C(石墨)?C(金刚石)是吸热反应,由此可知( )
| A、金刚石比石墨更稳定 |
| B、等质量的石墨和金刚石,石墨具有的能量比金刚石高 |
| C、石墨比金刚石更稳定 |
| D、金刚石和石墨不能相互转化 |
一定量的锌粉和6mol?L-1的过量盐酸反应,当向其中加入少量的下物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是( )
| A、①③④ | B、①③⑤ |
| C、②④⑧ | D、①⑤⑦ |
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A、7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| B、15g甲醛(HCHO)和乙酸的混合物中氧原子数为0.5NA |
| C、一定条件下,1.4g N2与0.2mol H2混合充分反应,转移的电子数为0.3NA |
| D、常温下,2L pH=12的Na2CO3溶液中含有的OH-数目为0.02NA |
下列表达正确的是( )
A、NaCl的电子式: |
B、CO2的分子模型示意图: |
C、CrO5的结构式为: 该氧化物中Cr为+6价 该氧化物中Cr为+6价 |
| D、次氯酸的结构式:H-Cl-O |
