题目内容
7.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如表所示数据(盐酸的物质的量浓度相等),下列分析推理不正确的是( )| 盐酸的体积/mL | 50 | 50 | 50 |
| 混合物的质量/g | 9.2 | 15.7 | 27.6 |
| CO2的体积(标准 状况下)/L | 2.24 | 3.36 | 3.36 |
| A. | 盐酸的物质的量浓度为3.0 mol•L-1 | |
| B. | 根据表中数据能计算出混合物中NaHCO3的质量分数为45.65% | |
| C. | 加入混合物9.2 g时盐酸过量 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
分析 A、求盐酸浓度需选择盐酸不足量的数据进行,如随着混合物质量增加,二氧化碳气体量不再增加,表明盐酸全部反应完,由表中数据可知,盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑计算n(HCl),再利用c=$\frac{n}{V}$计算;
B、由表中数据可知,故加入9.2g混合物时,盐酸有剩余,混合物完全反应,固体混合物的总质量及产生标准状况下的二氧化碳气体的体积可以计算出NaHCO3的质量分数;
C、由于固体混合物从9.2 g→15.7 g,二氧化碳气体的体积还在增加,故加入9.2 g混合物时盐酸过量;
D、加入9.2g混合物时,盐酸有剩余,混合物完全反应,根据固体混合物与气体的比例关系计算产生3.36 L二氧化碳所需固体质量计算判断.
解答 解:A、求盐酸浓度需选择盐酸不足量的数据进行,如随着混合物质量增加,二氧化碳气体量不再增加,表明盐酸全部反应完,由表中数据可知,盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑可知n(HCl)=$\frac{3.36L}{22.4L/mol}$=0.15mol,故盐酸的浓度为$\frac{0.15mol}{0.05L}$=3mol/L,故A正确;
B、设NaHCO3的物质的量为x,KHCO3的物质的量为y,则有x+y=0.1mol,84 g•mol-1×x+100 g•mol-1×y=9.2 g,解得x=0.05 mol,NaHCO3的质量分数为$\frac{0.05mol×84g/mol}{9.2g}$×100%=45.65%,故B正确;
C、由于固体混合物从9.2 g→15.7 g,二氧化碳气体的体积还在增加,故加入9.2 g混合物时盐酸过量,故C正确;
D、加入9.2g混合物时,盐酸有剩余,混合物完全反应,根据固体混合物与气体的比例关系可知,产生3.36 L二氧化碳所需固体质量为$\frac{3.36L}{2.24L}$×9.2g=13.8 g,此时盐酸恰好完全反应,混合物有剩余,故D错误;
故选D.
点评 考查混合物的有关计算,难度中等,根据二氧化碳的体积变化判断盐酸是否完全反应式是关键,再根据气体体积与固体质量关系进行解答.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案| A. | 简单离子的半径:E>F>C>D | |
| B. | 分子AC2中各原子最外层均满足8电子结构 | |
| C. | 由D、F组成的盐溶液蒸干后可以得到原溶质 | |
| D. | 元素B的最高价氧化物对应的水化物与其氢化物可以反应生成一种盐 |
| A. | 稀硫酸、氢氧化钠溶液能导电,所以它们都是电解质 | |
| B. | 电解质溶液通电时,电解质才能发生电离 | |
| C. | 水溶液能导电的化合物不一定是电解质 | |
| D. | 难溶物质肯定不是电解质 |
| A. | 1:2 | B. | 2:5 | C. | 1:10 | D. | 1:8 |
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| F | x+3 | x+4 |
(1)各元素的元素符号分别为BMg,ES,FCl;
(2)试写出A、C最高价氧化物对应的水化物之间反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O
(3)D、E氢化物的稳定性:H2S>SiH4
(4)试写出A、B、E、F形成的简单离子半径由小到大的顺序:S2->Cl->Na+>Mg2+.
| A. | 原子半径:Al>Mg>Na | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 酸性:HClO4>H2SO4>H2PO4 | D. | 金属性:Na>Mg>Al |
 )常用于汽水、糖果的添加剂,
)常用于汽水、糖果的添加剂, ;
;
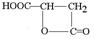 .
.