题目内容
4.用铝片与稀硫酸反应制取氢气时,下列措施一定能使氢气生成速率加大的是( )| A. | 不用铝片,改用铝粉 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 不用稀硫酸,改用浓硝酸 | D. | 加入少量稀盐酸 |
分析 A.增大接触面积,反应速率加快;
B.Al在浓硫酸中发生钝化;
C.Al在浓硝酸中发生钝化;
D.加入少量稀盐酸,溶液中氢离子浓度可能降低.
解答 解:A.不用铝片,改用铝粉,增大接触面积,反应速率加快,故A正确;
B.Al在浓硫酸中发生钝化,没有氢气生成,故B错误;
C.Al在浓硝酸中发生钝化.没有氢气生成,故C错误;
D.加入少量稀盐酸,溶液中氢离子浓度可能降低,生成氢气的速率可能减小,故D错误,
故选:A.
点评 本题考查化学反应速率影响因素,注意Al在浓硝酸、浓硫酸中发生钝化,题目经常会涉及生成氢气的量不变问题,比较基础.

练习册系列答案
相关题目
15.下列有关电解质的说法,正确的是( )
| A. | 稀硫酸、氢氧化钠溶液能导电,所以它们都是电解质 | |
| B. | 电解质溶液通电时,电解质才能发生电离 | |
| C. | 水溶液能导电的化合物不一定是电解质 | |
| D. | 难溶物质肯定不是电解质 |
19.今有原子序数依次培大的A.B、C、D、E、F六种元素.已知A、C、E三元素原子的最外层共有10个电子.且这三种元素的最高价氧化物对应的水化物之间,两两皆能反应且均能生成盐和水.D和F各有如下表的电子层结构.
按要求填空:
(1)各元素的元素符号分别为BMg,ES,FCl;
(2)试写出A、C最高价氧化物对应的水化物之间反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O
(3)D、E氢化物的稳定性:H2S>SiH4
(4)试写出A、B、E、F形成的简单离子半径由小到大的顺序:S2->Cl->Na+>Mg2+.
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| F | x+3 | x+4 |
(1)各元素的元素符号分别为BMg,ES,FCl;
(2)试写出A、C最高价氧化物对应的水化物之间反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O
(3)D、E氢化物的稳定性:H2S>SiH4
(4)试写出A、B、E、F形成的简单离子半径由小到大的顺序:S2->Cl->Na+>Mg2+.
3.下列各种说法中正确的是( )
| A. | 凡是能起银镜反应的物质一定是醛 | |
| B. | 乙烯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 酯在过量氢氧化钠溶液中水解生成的最终产物为酸和醇 | |
| D. | 苯酚有弱酸性,因此它是一种羧酸 |
7.对于在密闭容器中进行的工业合成氨的反应:N2+3H2?2NH3,下列说法错误的是 ( )
| A. | 使用合适的催化剂可以增大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大压强不影响反应速率 | |
| D. | 增大N2浓度可以增大反应速率 |
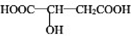 )常用于汽水、糖果的添加剂,
)常用于汽水、糖果的添加剂,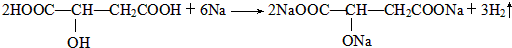 ;
;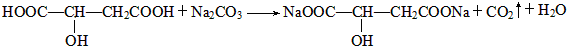
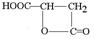 .
.