题目内容
15.二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域.已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂.下列说法不正确的是( )| A. | 二茂铁属于分子晶体 | |
| B. | 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键 | |
| C. | 已知环戊二烯的结构式为: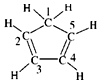 ,则其中仅有1个碳原子采取sp3杂化 ,则其中仅有1个碳原子采取sp3杂化 | |
| D. | C5H5-中一定含π键 |
分析 A.由信息可知,二茂铁熔沸点较低;
B.C5H5-与Fe2+之间形成的化学键为配位键;
C.由图可知,只有1号C形成4个单键;
D.双键中含有一个π键和一个ó键.
解答 解:A.由信息可知,二茂铁熔沸点较低,则二茂铁属于分子晶体,故A正确;
B.C5H5-与Fe2+之间形成的化学键时亚铁离子提供空轨道,C提供孤对电子,二者形成配位键,故B错误;
C.由图可知,只有1号C形成4个单键,则仅有1个碳原子采取sp3杂化,故C正确;
D.已知C5H5-中含有C=C,双键中含有一个π键和一个ó键,则C5H5-中一定含π键,故D正确;
故选B.
点评 本题考查原子的杂化、化学键等,为高频考点,把握原子结构与性质、分子结构与性质为解答的关键,侧重分析与应用能力的考查,注意信息的应用及知识迁移应用,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
5.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol氦气中有2NA个氦原子 | |
| B. | 14 g氮气中含6.02×1023个氮原子 | |
| C. | 2 L 0.3 mol•L-1 Na2SO4溶液中含0.6 NA个Na+ | |
| D. | 18 g水中所含的电子数为10NA |
3.下列说法正确的是( )
| A. | 可用 和HCHO 为原料合成 和HCHO 为原料合成  | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | C3H8的六氯代物共有4种,而且CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| D. | 将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是还原糖 |
10.把NaHCO3和Na2CO3•10H2O混合物5.38g溶于水制成100mL溶液,其中c(Na+)=0.4mol/L.如果把5.38g这种混合物加热至恒重所得固体的质量( )
| A. | 2.65g | B. | 2.12g | C. | 3.9g | D. | 4.65g |
4.下列叙述中正确的是( )


| A. | FeCl3溶液、Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是有没有丁达尔效应 | |
| B. | 根据分散系的稳定性的大小将混合物分为胶体、溶液和浊液 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| D. | 胶体、分散系、混合物概念间的从属关系可用下图表示 |
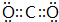 ,BA2分子中化学键属于共价键.
,BA2分子中化学键属于共价键. 工业上常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和H2),其反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.请回答下列问题:
工业上常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和H2),其反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.请回答下列问题: