题目内容
7. 工业上常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和H2),其反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.请回答下列问题:
工业上常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和H2),其反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.请回答下列问题:(1)若用炭粉和水蒸气在恒容密闭容器中进行反应,当反应达到平衡后,再充入H2O(g),则其正反应速率将增大(填“增大”“减小”或“不变”).
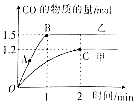
(2)如图分别是炭粉和水蒸气在不同温度、体积均为2L的甲、乙两个恒容密闭容器中反应达到平衡的示意图,投入反应物的量完全相同.
①甲容器中,0~2min内的平均反应速率v(H2)=0.3mol/(L•min).
②两容器温度:甲乙(填“>”“<”或“=”,下同)乙.
③B点和C点的化学反应速率:v(B)Bv(C).
分析 (1)增大反应物浓度,正反应速率增大;
(2)①由图象可知甲容器中,0~2min内生成CO1.2mol,由方程式可知生成氢气1.2mol,进而可计算生成氢气的反应速率;
②升高温度,可增大反应速率,达到平衡时时间较少;
③根据温度的高低判断反应速率的大小.
解答 解:(1)当反应达到平衡后,再充入H2O(g),反应物浓度增大,则其正反应速率将增大,故答案为:增大;
(2)①由图象可知甲容器中,0~2min内生成CO1.2mol,由方程式可知生成氢气1.2mol,则v(H2)=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol/(L•min),故答案为:0.3mol/(L•min);
②升高温度,可增大反应速率,达到平衡时时间较少,可知乙温度较高,故答案为:乙;
③由图象可知乙的温度较高,则B点的反应速率较大,故答案为:B.
点评 本题综合考查化学平衡问题,为高频考点,侧重考查学生的分析能力,主要把握图象中曲线的变化特点,把握外界条件对平衡移动的影响,难度不大.

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
17.为了提纯表所列物质(括号内为杂质),请把除杂试剂和分离方法填入相应的表格中.
| 题号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| 1 | 丙烷(丙烯) | ||
| 2 | CH3CH2OH (CH3COOH) | ||
| 3 | 苯(溴) | ||
| 4 | 乙烯(SO2、CO2) | ||
| 5 | CO2(SO2) |
18.为了配制NH4+的浓度与Cl-的浓度之比为1:1的溶液,可在NH4Cl溶液中加入( )
| A. | 适量的HCl | B. | 适量的NaCl | C. | 适量的氨水 | D. | 适量的NaOH |
15.二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域.已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂.下列说法不正确的是( )
| A. | 二茂铁属于分子晶体 | |
| B. | 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键 | |
| C. | 已知环戊二烯的结构式为: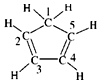 ,则其中仅有1个碳原子采取sp3杂化 ,则其中仅有1个碳原子采取sp3杂化 | |
| D. | C5H5-中一定含π键 |
2.W、X、Y、Z是原子序数依次增大的四种短周期元素,已知W的原子半径是所有元素中最小,四种元素的电子层数之和及最外层电子数之和均为10,且它们分别属于连续的四个主族.下列说法正确的是( )
| A. | W、X、Y元素的简单离子对水的电离平衡的影响是相同的 | |
| B. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 | |
| C. | X、Y、Z的最高价氧化物对应的水化物两两之间能反应 | |
| D. | Y元素所形成的离子是其所在周期中半径最小的简单离子 |
12.下列说法正确的是( )
| A. | 某化合物的熔融状态能导电,该化合物中一定有离子键 | |
| B. | 冰是分子晶体,受热分解的过程中,只需克服分子间的作用力 | |
| C. | 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,物理变化中一定没有化学键的破坏或形成 |
16.Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于表:
回答下列问题:
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态).
(2)Fe原子或离子外围有较多能量相近的空轨道,能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是具有孤对电子.
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为分子晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1,其中体心立方晶胞空间利用率为68%.
| 元素 | Mn | Fe | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态).
(2)Fe原子或离子外围有较多能量相近的空轨道,能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是具有孤对电子.
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为分子晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1,其中体心立方晶胞空间利用率为68%.
17.现有14g乙烯和丙烯的混合气体.下列有关说法正确的是( )
| A. | 标准状况下混合气体的体积为22.4L | |
| B. | 完全燃烧生成44g CO2 | |
| C. | 混合气体中氢原子个数为2NA | |
| D. | 完全燃烧转移的电子数为3mol |