题目内容
4.下列叙述中正确的是( )
| A. | FeCl3溶液、Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是有没有丁达尔效应 | |
| B. | 根据分散系的稳定性的大小将混合物分为胶体、溶液和浊液 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| D. | 胶体、分散系、混合物概念间的从属关系可用下图表示 |
分析 根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),据此分析.
解答 解:A.胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同,分散质微粒直径介于1-100nm的为胶体,故A错误;
B.根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),故B错误;
C.根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),故C错误;
D.胶体属于分散系,而分散系都是由两种以上的物质组成,则属于混合物,故D正确.
故选D.
点评 本题考查了分散系溶液、浊液、胶体的区别,注意相关基础知识的积累,题目难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
14.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平,青铜(约6000年前)、Fe(约2500年前)、Al(约200年前)之所以有先有后,主要取决于( )
| A. | 金属的导电性强弱 | B. | 金属在地壳中的含量多少 | ||
| C. | 金属的化合价高低 | D. | 金属的活动性强弱 |
15.二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域.已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂.下列说法不正确的是( )
| A. | 二茂铁属于分子晶体 | |
| B. | 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键 | |
| C. | 已知环戊二烯的结构式为: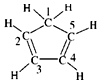 ,则其中仅有1个碳原子采取sp3杂化 ,则其中仅有1个碳原子采取sp3杂化 | |
| D. | C5H5-中一定含π键 |
12.下列说法正确的是( )
| A. | 某化合物的熔融状态能导电,该化合物中一定有离子键 | |
| B. | 冰是分子晶体,受热分解的过程中,只需克服分子间的作用力 | |
| C. | 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,物理变化中一定没有化学键的破坏或形成 |
9.下列化学用语正确的是( )
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | 汽车尾气净化反应2NO+2CO=2CO2+N2能够自发进行,则该反应的△H>0 | |
| D. | 碳在高温下还原二氧化硅SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
16.Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于表:
回答下列问题:
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态).
(2)Fe原子或离子外围有较多能量相近的空轨道,能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是具有孤对电子.
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为分子晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1,其中体心立方晶胞空间利用率为68%.
| 元素 | Mn | Fe | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态).
(2)Fe原子或离子外围有较多能量相近的空轨道,能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是具有孤对电子.
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为分子晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1,其中体心立方晶胞空间利用率为68%.
13.下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
①Na2SiO3 ②AlCl3 ③NH4HCO3 ④Al2O3 ⑤NaHCO3⑥Al ⑦Al(OH)3.
①Na2SiO3 ②AlCl3 ③NH4HCO3 ④Al2O3 ⑤NaHCO3⑥Al ⑦Al(OH)3.
| A. | ①②④ | B. | ②③⑤⑦ | C. | ②③⑥ | D. | ③④⑤⑥⑦ |
2.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 焰火的五彩缤纷是某些金属元素化学性质的表现 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆的原理相似 | |
| D. | 明矾作为净水剂,可以除去废水中的铜离子 |