题目内容
4.有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )| A. | A>B>E>D | B. | A>B>D>E | C. | D>A>B>E | D. | D>E>A>B |
分析 原电池中,电子由负极流向正极,活泼金属作负极,负极上失去电子,以此来比较金属的活泼性.
解答 解:当A、B组成原电池时,电子流动方向A→B,则金属活泼性为A>B;
当A、D组成原电池时,A为正极,则金属活泼性为D>A;
B与E构成原电池时,电极反应式为:E2-+2e-→E,B-2e-→B2+,B失去电子,则金属活泼性为B>E,
综上所述,金属活泼性为D>A>B>E,
故选C.
点评 本题考查原电池原理及金属活泼性的比较,明确活泼金属作负极,失去电子及电子的流向即可解答,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.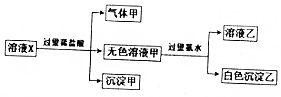 水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )
水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )
 水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )
水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )| A. | 溶液X可能含有Mg2+或Al3+ | |
| B. | 沉淀甲只可能是硅酸沉淀 | |
| C. | 有气体甲生成,表明溶液X中一定含有CO32- | |
| D. | 不能确定SO42-是否存在于溶液X中 |
15.月球的土壤中吸附着百万吨的氦(He-3)),其原子核中质子数为2、中子数为1.下列关于氦原子(He-3)
的说法正确的是( )
的说法正确的是( )
| A. | 原子核外电子数为3 | B. | 相对原子质量为2 | ||
| C. | 原子的核电荷数为3 | D. | 原子结构示意图为  |
12.下列分离或提纯物质所用的方法不正确的是( )
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用分液的方法分离乙醇和水的混合物 | |
| C. | 用萃取的方法提取碘水中的碘 | |
| D. | 用结晶的方法分离氯化钠和硝酸钾的混合物 |
14.下列有关化学用语表示正确的是( )
| A. | ${\;}_{8}^{16}$O2-离子的结构示意图: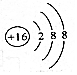 | |
| B. | 碳酸氢钠熔融时的电离方程式:NaHCO3?Na++HCO3- | |
| C. | 次氯酸的结构式:Cl-O-H | |
| D. | 过氧化氢的电子式: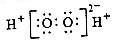 |
 .C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3
.C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3