题目内容
14.江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33mg/kg).测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol•L-1Na2S2O3溶液,与生成的碘恰好完全反应.有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程).
②该食盐试样是否符合江苏食用加碘盐新标准,并说明判断依据不符合,不在波动范围.
分析 ①通过此方程式I2+2S2O32-=2I-+S4O62-,中Na2S2O3的量求消耗I2的量,并通过KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O此方程式中I2的量求KIO3的量,并求得其碘元素的含量;
②据是否在波动范围18~33mg/kg中判断.
解答 解:①n(Na2S2O3)=12.00×10-3L×6.000×10-4mol•L-1=7.2×10-6mol
I2 +2S2O32-=2I-+S4O62-
1
3.6×10-6 7.2×10-6则消耗I2的量为3.6×10-6 mol,
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
1 3
1.2×10-6 3.6×10-6 则消耗KIO3的量为1.2×10-6 mol,根据碘元素守恒,则n(I)=n( KIO3 )=1.2×10-6 mol,
m(I)=1.2×10-6 mol×127g/mol=1.524×10-1mg,W(I)=$\frac{1.524×1{0}^{-1}mg}{4×1{0}^{-3}kg}$=38.1mg/kg
答:食盐试样中碘元素的含量38.1mg/kg;
②38.1mg/kg不在(波动范围为18~33mg/kg)中,故答案为:不符合,不在波动范围.
点评 本题难度不大,考查学生灵活运用化学式的有关计算进行分析问题,解决问题的能力.

练习册系列答案
相关题目
4.电子产品产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如图制备硫酸铜和硫酸铝晶体的路线:
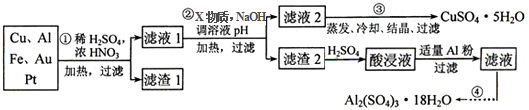
按要求回答下列问题:
(1)滤渣1中存在的金属有Au、Pt.
(2)已知沉淀物的pH如下表:
①则操作②中X物质最好选用的是d(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是4.4≤pH<4.9.
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+.
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:Al+Fe3+=Fe+Al3+.
(5)由CuSO4•5H2O制备CuSO4时,应把CuSO4•5H2O放在坩埚(填仪器名称)中加热脱水.
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为 3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2,每有1mol K2FeO4被还原,转移电子的物质的量为3mol,充电时阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O.

按要求回答下列问题:
(1)滤渣1中存在的金属有Au、Pt.
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是4.4≤pH<4.9.
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+.
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:Al+Fe3+=Fe+Al3+.
(5)由CuSO4•5H2O制备CuSO4时,应把CuSO4•5H2O放在坩埚(填仪器名称)中加热脱水.
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为 3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2,每有1mol K2FeO4被还原,转移电子的物质的量为3mol,充电时阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O.
5.下列关于1mol/L Na2SO4溶液的说法正确的是( )
| A. | 溶液中含有1molNa+ | |
| B. | 将142g Na2SO4溶于少量水后再稀释到 100mL | |
| C. | 1 mol Na2SO4溶于1 L蒸馏水中 | |
| D. | 1 L溶液中含有142 g Na2SO4 |
2.假设SiO2原子晶体中Si原子被Al原子取代,不足的价数由K原子补充.当有25%的硅原子被铝原子取代时,可形成正长石,则正长石的化学组成为( )
| A. | KAlSiO4 | B. | KAlSi2O6 | C. | KAlSi3O8 | D. | KAlSi4O10 |
6.以下实验装置一般能用于分离物质的是( )


| A. | 只有①② | B. | 只有②③ | C. | 只有①②③ | D. | ①③ |
3.根据有机化合物的命名原则,下列命名正确的是( )
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 3-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
4.某一元弱酸溶液的c(H+)=0.1mol/L,该酸溶液的物质的量浓度为( )
| A. | 等于0.1mol/L | B. | 大于0.1mol/L | C. | 小于0.1mol/L | D. | 无法判断 |
 ;
;