题目内容
4.现有一份含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,设计出如下路线制备胆矾和硫酸铝晶体: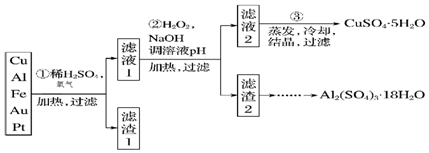
请回答下列问题:
(1)第①步Cu与酸、氧气反应的离子方程式为2Cu+4H++O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O;
(2)第②步加H2O2的作用是( 用离子方程式表示原因)2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了三种方案:
甲:滤渣2$\stackrel{H_{2}SO_{4}}{→}$酸浸液$\stackrel{蒸发、冷却、结晶、过滤}{→}$Al2(SO4)3•18H2O
乙:滤渣2$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{过滤}^{适量Al粉}$滤液$\stackrel{蒸发、冷却、结晶、过滤}{→}$Al2(SO4)3•18H2O
丙:滤渣2$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$滤液$\stackrel{蒸发、冷却、结晶、过滤}{→}$Al2(SO4)3•18H2O
上述三种方案中,甲方案的缺陷是所得产品中含有较多Fe2(SO4)3杂质;等量滤渣生成Al2(SO4)3•18H2O最多的是方案乙.
分析 Cu、Al及少量Fe、Au、Pt等金属的混合物中加入硫酸和浓硝酸的混合物溶解,可以得到铁盐、铝盐、铜盐等,Au、Pt等不容无可以滤出,向混合液中加入双氧水和氢氧化钠,加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀,依据图表数据分析可知,溶液PH调节为5.2~5.4,使Fe3+和Al3+形成沉淀,铜离子不沉淀,向沉淀物质中加入氢氧化钠可以实现氢氧化铁和氢氧化钠的分离,先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,以此解答该题.
解答 解:(1)酸性条件下,铜可被氧化生成铜盐,反应的离子方程式为2Cu+4H++O2 $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O,故答案为:2Cu+4H++O2 $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O;
(2)因铁离子易生成沉淀,加入过氧化氢,可将亚铁离子氧化生成铁离子,发生2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,故不合理,乙方案在加入硫酸的基础上加入铝,生成更多的Al2(SO4)3•18H2O,
故答案为:所得产品中含有较多Fe2(SO4)3杂质;乙.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程及物质组成、性质、发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度中等.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 活性炭有还原性,可用作制糖业脱色剂 | |
| B. | 二氧化氯有强氧化性,可用于饮用水消毒 | |
| C. | 氯化铁溶液呈酸性,可用于蚀刻铜电路板 | |
| D. | 晶体硅的熔点高、硬度大,可用于制作半导体材料 |
| A. | 漂白粉 | B. | 漂白液 | C. | 臭氧 | D. | SO2 |
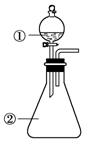 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| D | 饱和氯化铁溶液 | 浓氢氧化钠溶液 | 溶液呈红褐色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | F2O | B. | CO2 | C. | ClO2 | D. | CN- |
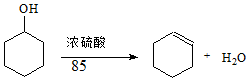
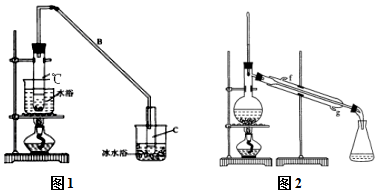 某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯已知:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
①A中碎瓷片的作用是防暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是防止环己烯挥发或冷凝环己烯.
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上 层(填上或下),分液后,用CD(填编号)洗涤环己烯.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.NaOH溶液
②再将环己烯按图2装置蒸馏,冷却水从g(填f或g)口进入,蒸馏时要加入生石灰,目的是除水.
③收集产品时,控制的温度应在83℃ 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最简单的方法是BC.
A.酸性KMnO4溶液 B.用金属钠 C.测定沸点 D.溴的四氯化碳溶液.
| A. | 反应速率增大 | B. | 平衡向右移动 | C. | 体系温度升高 | D. | W的质量分数降低 |
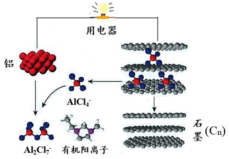 近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时,A1Cl4-向石墨电极移动 | |
| C. | 放电时,负极的电极反应式为A1十7A1Cl4--3e-=4 A12Cl7- | |
| D. | 充电时,电子从石墨电极直接经导线流入铝电极,然后再经电解质溶液流回石墨电极 |