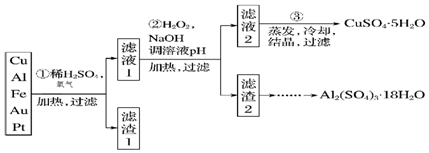
题目内容
13.在绝热密闭容器中发生反应:aM(g)+bN(g)?cW(g) 达平衡后,测得M气体的浓度为0.5mol/L.若将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L.则下列叙述正确的是( )| A. | 反应速率增大 | B. | 平衡向右移动 | C. | 体系温度升高 | D. | W的质量分数降低 |
分析 达平衡后,测得M气体的浓度为0.5mol/L,将密闭容器的体积扩大1倍,原则上是M气体的浓度为原来的一半,即为0.25mol/L,但是当再达平衡时,测得M气体的浓度为0.3mol/L>0.25mol/L,可知体积增大,压强减小,化学平衡逆向移动,以此来解答.
解答 解:A.将密闭容器的体积扩大1倍,则气体的压强减小,化学反应速率减慢,故A错误;
B.由上述分析可知,化学平衡向着逆反应方向进行,故B错误;
C.反应的焓变未知,不能确定体系温度的变化,故C错误;
D.化学平衡逆向移动,W的质量分数降低,故D正确;
故选D.
点评 本题考查化学平衡移动,为高考常见题型和高频考点,把握压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意动态与静态的结合,选项C为解答的难点,题目难度不大.

练习册系列答案
相关题目
1.下列有关物质的性质或该物质性质的应用均正确的是( )
| A. | 醋酸溶液与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是一样的 | |
| C. | MgO和Al2O3在工业上用于制作耐高温材料,可用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
1.在一定条件下,N2O分解的部分实验数据如表:
图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O)/mol•L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间/min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O)/mol•L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
| A. | 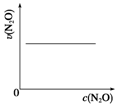 | B. |  | C. | 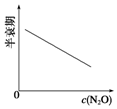 | D. |  |
18.下列实验事实能达到目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| B | 室温下,用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液和0.1 mol•L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| D | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
5.原子序数依次增大的a、b、c、d四种主族元素,其中a和d同族,a-的电子层结构与氦相同,b和c的次外层有8个电子,b2-、c-和d+的电子层结构相同.下列错误的是( )
| A. | 元素的非金属性次序为c>b>a | |
| B. | a-的还原性弱于c-的还原性 | |
| C. | d和其他3种元素均能形成离子化合物 | |
| D. | 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 |
2.下列说法正确的是( )
| A. | 酶属于碳水化合物,是生物体中重要的催化剂 | |
| B. | 纤维素为天然高分子化合物,遇碘水会变蓝色 | |
| C. | 某些卤代烃能破坏臭氧层,使卤代烃的使用受到限制 | |
| D. | 某有机物的1H核磁共振谱图中特征峰的数目就是氢原子数 |
3.一种阳光驱动的二氧化碳捕获装置如图所示,下列说法正确的是( )


| A. | 该装置的能量转化方式为太阳能转化为电能 | |
| B. | 工作时,阳极附近pH减小 | |
| C. | 电路中每转移4mol电子,捕获44g二氧化碳 | |
| D. | 阴极的电极反应为CO2+2e-=CO+O2- |