题目内容
7.在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示.下列说法不正确的是( )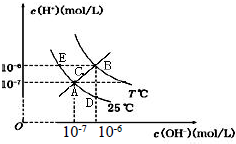
| A. | 图中五点Kw间的关系:B>C>A=D=E | |
| B. | E 点对应的水溶液中,可能有NH 4+、Ba 2+、Cl-、I-大量同时存在 | |
| C. | 若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A) | |
| D. | 向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO4 2-+Ba2++2OH-=BaSO4↓+2H2O |
分析 由图象可知,A、E、D都为25℃时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,水的离子积只与温度有关,与溶液的类型无关,可能为纯水,也可能为酸、碱、盐溶液.
解答 解:A.由图象可知,A、E、D都为25℃时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,则B>A=D=E,由C点c(OH-)×c(H+)可知,C点的Kw大于A点小于B,所以B>C>A=D=E,故A正确;
B.E点c(OH-)<c(H+),溶液呈酸性,酸性条件下,NH4+、Ba2+、Cl-、I-没有沉淀、气体、弱电解质、氧化还原反应产生,所以能共存,故B正确;
C.D点溶液中c(OH-)>c(H+),溶液呈碱性,说明HA-的水解程度大于电离程度,所以c(A2-)<c(H2A),故C错误;
D.D点时,Kw=1×10-14,pH=7,溶液显示中性,向NaHSO4溶液中滴入Ba(OH)2溶液,溶液中反应:2H++SO4 2-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
故选C.
点评 本题考查弱电解质的电离,题目难度中等,注意分析图象,把握水的离子积只受温度的影响.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
17.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯酚与浓溴水可直接反应,而苯与液溴反应则需要FeBr3作催化剂 |
18.已知:2SO2 (g)+O2(g)?2SO3(g)△H,有关数据如下:
下列说法不正确的是( )
| T(℃) | 527 | 627 | 727 | 827 | 927 |
| 平衡常数K | 910 | 42 | 3.2 | 0.39 | 0.12 |
| A. | 根据平衡常数随温度的变化关系,判断出△H<0 | |
| B. | 保持其他条件不变,SO2的平衡转化率α(727℃)<α(927℃) | |
| C. | 增大压强、降低温度能提高SO2的转化率 | |
| D. | SO3的稳定性随温度的升高而降低 |
15.下列叙述正确的是( )
| A. | 常温下NO2是无色气体,能与水发生反应 | |
| B. | SiO2难溶于水,不能与NaOH溶液反应 | |
| C. | 浓硝酸能与铜反应生成H2 | |
| D. | 实验室常用NH4Cl和Ca(OH)2固体混合物加热来制取NH3 |
12.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如图1实验流程:

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.图2中A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得:反应前氧化铜的质量为m1g,氧化铜反应后剩余固体的质量为m2g,生成氮气在标准状下的体积为V1L.
乙小组测得:洗气前装置D的质量为m3g,洗气后装置D的质量为m4g,生成氮气在标准状况下的体积为V2 L.
请回答下列问题:
(1)写出仪器a的名称:圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中;用手紧握试管或加热试管,导管口有气泡产生;松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填 写在如表的空格中.
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为5V1:7(m1-m2).
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.
为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.图2中A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得:反应前氧化铜的质量为m1g,氧化铜反应后剩余固体的质量为m2g,生成氮气在标准状下的体积为V1L.
乙小组测得:洗气前装置D的质量为m3g,洗气后装置D的质量为m4g,生成氮气在标准状况下的体积为V2 L.
请回答下列问题:
(1)写出仪器a的名称:圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中;用手紧握试管或加热试管,导管口有气泡产生;松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填 写在如表的空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4 |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用______ |
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.
为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
19.下列描述正确的是( )
| A. | 向浓氨水中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤后,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液X中含有CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃Y中含有氯原子 |
16.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:

| A. | 溶液甲中一定含有K2SiO3、K2CO3,肯定不含MgCl2,可能含有K2SO3 | |
| B. | 为确定气体A组成,可先将气体通入品红溶液,再通过澄清石灰水 | |
| C. | 固体乙中肯定含有MnO2,可能含有FeO和Fe2O3中的至少一种 | |
| D. | 有色气体D可能是Cl2,也可能是Cl2、SO2的混合气体 |
17.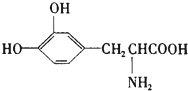 L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下
L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下
下列关于L-多巴胺的叙述不正确的是( )
 L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下
L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下下列关于L-多巴胺的叙述不正确的是( )
| A. | 它属于α-氨基酸,既具有酸性,又具有碱性 | |
| B. | 它遇到Fe2(SO4)3溶液显紫色 | |
| C. | 他可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环 | |
| D. | 它既与酸反应又与碱反应,等物质的量的L-多巴胺最多消耗NaOH与HCl物质的量之比为1:1 |
 .
.