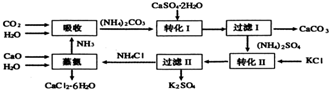
题目内容
18.已知:2SO2 (g)+O2(g)?2SO3(g)△H,有关数据如下:| T(℃) | 527 | 627 | 727 | 827 | 927 |
| 平衡常数K | 910 | 42 | 3.2 | 0.39 | 0.12 |
| A. | 根据平衡常数随温度的变化关系,判断出△H<0 | |
| B. | 保持其他条件不变,SO2的平衡转化率α(727℃)<α(927℃) | |
| C. | 增大压强、降低温度能提高SO2的转化率 | |
| D. | SO3的稳定性随温度的升高而降低 |
分析 A.根据表中数据,温度升高,平衡常数K在减小,说明该反应正方向是放热反应,△H<0;
B.平衡常数代表反应进行的程度大小,K越大,进行的程度越大,转化率越高;
C.增大压强,平衡向气体积缩小的方向移动,降低温度,平衡向放热方向移动;
D.能量越低越稳定.
解答 解:A.根据表中数据,温度升高,平衡常数K在减小,说明该反应正方向是放热反应,△H<0,故A正确;
B.平衡常数代表反应进行的程度大小,K越大,进行的程度越大,转化率越高,727℃的K=3.2,927℃的K=0.12,所以SO2的平衡转化率α(727℃)>α(927℃),故B错误;
C.2SO2 (g)+O2(g)?2SO3(g)△H<0,正方向是气体体积缩小的反应且是放热反应,所以增大压强、降低温度,都使平衡正向移动,提高了SO2的转化率,故C正确;
D.由于能量越低越稳定,当温度升高,从外界获得了能量,稳定性变差,所以SO3的稳定性随温度的升高而降低,故D正确;
故选B.
点评 本题考查了化学平衡的影响因素以及平衡常数与温度、转化率的关系,属于基础知识,也是高考常考知识,题目难度适中.

练习册系列答案
相关题目
8.关于某溶液中所含离子的检验,下列判断正确的是( )
| A. | 加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含SO42- | |
| B. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含K+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ |
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 室温下,1L pH=1的硫酸溶液中,含有H+的数目为0.1NA | |
| B. | 22.4L HCl和22.4L DCl中 所含质子数均为18NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 1 mol C3H6分子中碳碳共价键数为2NA |
6.据中国新闻网报道,青岛尾气遥感检测车上岗,0.7秒测出尾气超标车辆.汽车尾气净化的反应如下:NO(g)+CO(g)???$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ•mol-1.下列说法正确的是( )
| A. | 升高温度,平衡常数增大 | |
| B. | 当v(CO2)正=$\frac{1}{2}$v(N2)逆时,说明反应达到平衡状态 | |
| C. | 增加CO的物质的量浓度,NO的转化率增大 | |
| D. | 增大压强,正反应速率增大,逆反应速率减小 |
3.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
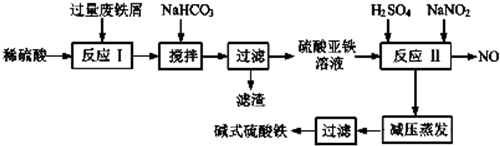
已知部分阳离子以氧氧化物形式沉淀的溶液的pH见表.回答下列问题:
(1)碱式硫酸铁能够净水的原因是能水解生成具有吸附能力较强的胶体.
(2)加入少量NaHCO3的目的是调节溶液的pH,使溶液中的Al3+沉淀.
(3)假设沉淀完全溶解时溶液中金属离子的浓度为1.0×10-5mol•L-1,试估算Ksp[Fe(OH)2]=10-15.
(4)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,该反应的离子方程式为2H++Fe2++NO3-=Fe3++NO↑+H2O
(5)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有SO42-,可供选择的试剂如下:
A.新制氯水 B.0.l mol•L -1KSCN溶液
C.10%NaOH溶液 D.20%HNO3溶液
E.0.05mol•L-1酸性KMnO4溶液 F.0.1mol•L-1BaCl2溶液
请你帮助该同学完成实验,将相关项目填入表中:
(7)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.已知:
2Fe2++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为5.6g•L-1.
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
(1)碱式硫酸铁能够净水的原因是能水解生成具有吸附能力较强的胶体.
(2)加入少量NaHCO3的目的是调节溶液的pH,使溶液中的Al3+沉淀.
(3)假设沉淀完全溶解时溶液中金属离子的浓度为1.0×10-5mol•L-1,试估算Ksp[Fe(OH)2]=10-15.
(4)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,该反应的离子方程式为2H++Fe2++NO3-=Fe3++NO↑+H2O
(5)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有SO42-,可供选择的试剂如下:
A.新制氯水 B.0.l mol•L -1KSCN溶液
C.10%NaOH溶液 D.20%HNO3溶液
E.0.05mol•L-1酸性KMnO4溶液 F.0.1mol•L-1BaCl2溶液
请你帮助该同学完成实验,将相关项目填入表中:
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀 | 得红棕色溶液 | 溶液中含有Fe3+ |
| 取少量溶液于试管中,滴加0.05mol/L的酸性高锰酸钾溶液 | 溶液不褪色 | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1mol/L的氯化钡溶液,再加入20%稀硝酸溶液 | 有白色沉淀 | 溶液中含有SO${\;}_{4}^{2-}$ |
2Fe2++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为5.6g•L-1.
7.在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示.下列说法不正确的是( )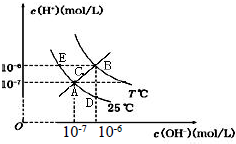

| A. | 图中五点Kw间的关系:B>C>A=D=E | |
| B. | E 点对应的水溶液中,可能有NH 4+、Ba 2+、Cl-、I-大量同时存在 | |
| C. | 若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A) | |
| D. | 向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO4 2-+Ba2++2OH-=BaSO4↓+2H2O |