题目内容
5.A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA2、BA3的型分子.B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小.请回答下列问题:(1)D元素在元素周期表中的位置是第四周期第ⅠA族.B与D所形成的化合物的化学键类型为离子键.
(2)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为Cl2+K2S=2KCl+S↓.
分析 A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA2、BA3型分子,则A为氧元素、B为硫元素;B、C、D所形成的简单离子电子层结构相同,核外电子数为18,且B、C、D离子半径依次减小,则原子序数D>C>B,结合原子序数可知,D为K、C为Cl,据此解答.
解答 解:A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA3型分子,则A为氧元素、B为硫元素;B、C、D所形成的简单离子电子层结构相同,核外电子数为18,且B、C、D离子半径依次减小,则原子序数D>C>B,结合原子序数可知,D为K、C为Cl.
(1)D为K元素,在元素周期表中的位置是:第四周期第ⅠA族,B与D所形成的化合物为K2S,含有离子键,
故答案为:第四周期第ⅠA族;离子键;
(2)将氯气的水溶液滴加到K2S的水溶液中,产生淡黄色沉淀,生成硫,氯气被还还原,同时生成KCl,反应的化学方程式为:Cl2+K2S=2KCl+S↓,故答案为:Cl2+K2S=2KCl+S↓.
点评 本题考查结构性质位置关系应用,难度不大,根据同主族元素形成物质的分子式为突破口进行推断,注意对基础知识的理解掌握.

练习册系列答案
相关题目
13.短周期主族元素X、Y、Z、W在周期表中的相对位置如表,四种元素的原子最外层电子数之和为20.下列说法正确的是( )
| X | Y | Z |
| W |
| A. | W位于第三周期ⅥA族 | |
| B. | 元素最高正价:Z>Y>X | |
| C. | 简单气态氢化物稳定性:W>Y>X | |
| D. | 工业上催化氧化Y的氢化物可用于制备其含氧酸 |
10.目前,关于二氧化碳是否为大气污染物有不同的观点:①二氧化碳是重要的化工原料 ②二氧化碳是植物光合作用的必需原料 ③二氧化碳是无色、无味、无毒的气体 ④除二氧化碳外,甲烷、一氧化二氮也是温室气体.认为“二氧化碳不是大气污染物”的理由是( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
15.某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性K2Cr2O7>Cl2,则下列说法不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:14 | |
| B. | Cl2是该反应的氧化产物 | |
| C. | 当转移0.2mol电子时,被氧化的还原剂的物质的量为0.2mol | |
| D. | 由此反应可知还原性HCl>CrCl3 |


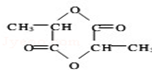 +2H2O.
+2H2O.
