题目内容
1.I.摩尔盐制备:将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体.根据下图回答: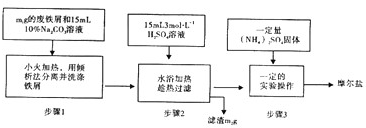
(1)步骤1中Na2CO3的主要作用是除去铁屑表面的油污.
(2)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、冷却结晶、减压过滤(或抽滤).
(3)步骤3中:加热是为了蒸发溶剂,浓缩结晶,应加热到溶液表面出现晶膜时,停止加热.不能蒸干的原因是蒸干时溶液中的杂质离子会被带入晶体中,蒸干时晶体会受热分解或氧化.
Ⅱ.产品中Fe2+的定量分析
将称取KMnO4固体并溶于水配成0.2mol•L-1250mL溶液.再称取8.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mol•L-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积20.00Ml.
(1)配制250mL MnO4溶液,所需的主要仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需要的玻璃仪器有250mL容量瓶.
(2)本实验指示剂是D(填字母).
A.甲基橙 B.石蕊 C.酚酞 D.不需要
(3)在滴定的过程中,要注意:
①使滴定管内的标准KMnO4溶液滴入锥形瓶中;
②边滴边振荡锥形瓶;
③眼睛注意观察锥形瓶中溶液颜色的变化和加入KMnO4溶液的速度:
④接近终点时应该减慢加入KMnO4溶液的速度.当溶液由无色变为浅红色,半分钟内不褪色,即达到滴定终点.
(4)写出该反应中Fe2+被氧化的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,则该产品中Fe2+的质量分数为14%.
分析 废铁屑在碳酸钠溶液中洗涤除去表面的油污,小火加热用倾析法分离洗涤铁屑,加入稀硫酸溶液水浴加热、趁热过滤,得到滤液中加入一定量硫酸铵固体,溶液表面出现晶膜时,停止加热,蒸干时溶液中的杂质离子会被带入晶体中,温度过高晶体分解货被空气中氧气氧化,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体,
I.(1)Na2CO3溶液中CO32-水解使Na2CO3溶液呈碱性,油脂在碳酸钠溶液中水解生成溶于水的物质;
(2)步骤3中,加入(NH4)2SO4固体后,因为温度过高晶体分解货被空气中氧气氧化,则采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到摩尔盐晶体;
(3)步骤3中,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,蒸干时溶液中的杂质离子会被带入晶体中,温度过高晶体分解货被空气中氧气氧化;
Ⅱ.(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器,实验具体操作步骤有:计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等;
(2)MnO4-为紫色,当滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点;
(3)滴定的一般步骤:①使滴定管内的标准KMnO4溶液滴入锥形瓶中;
②边滴边振荡锥形瓶;
③眼睛注意观察锥形瓶中溶液颜色的变化和加入KMnO4溶液的速度:
④接近终点时应该减慢加入KMnO4溶液的速度.当溶液由无色变为浅红色,半分钟内不褪色,即达到滴定终点;
(4)Fe2+被MnO4-氧化成三价铁离子,本身被还原成二价锰离子,据此书写离子方程式,根据离子方程式,计算8g产品中Fe2+的物质的量,进而计算Fe2+的质量,再根据质量分数定义计算.
解答 解:I.(1)Na2CO3溶液中CO32-水解CO32-+H2O?HCO3-+OH-,使Na2CO3溶液呈碱性,Na2CO3的主要作用是除去铁屑表面的油污,
故答案为:除去铁屑表面的油污;
(2)步骤3中,加入(NH4)2SO4固体后,因为温度过高晶体分解货被空气中氧气氧化,则采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到摩尔盐晶体,故答案为:冷却结晶;减压过滤(或抽滤);
(3)步骤3中,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,蒸干时溶液中的杂质离子会被带入晶体中,温度过高晶体分解货被空气中氧气氧化,故答案为:溶液表面出现晶膜时;蒸干时溶液中的杂质离子会被带入晶体中,蒸干时晶体会受热分解或氧化;
Ⅱ.(1)一定规格的容量瓶只能配制相应体积的溶液,容量瓶应选择250ml规格;
溶液配制步骤为:一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,
所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、250ml容量瓶、胶头滴管,故上述仪器配制溶液时还需要的玻璃仪器是:250mL容量瓶,
故答案为:250mL容量瓶;
(2)MnO4-为紫色,当滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,故不需要外加指示剂,故选:D;
(3)滴定的一般步骤:①使滴定管内的标准KMnO4溶液滴入锥形瓶中;
②边滴边振荡锥形瓶;
③眼睛注意观察锥形瓶中溶液颜色的变化和加入KMnO4溶液的速度:
④接近终点时应该减慢加入KMnO4溶液的速度.当溶液由无色变为浅红色,半分钟内不褪色,即达到滴定终点;
故答案为:边滴边振荡锥形瓶;溶液由无色变为浅红色,半分钟内不褪色;
(4)Fe2+被MnO4-氧化成三价铁离子,本身被还原成二价锰离子,离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
令4g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.02L×0.2mol/L
所以x=$\frac{0.02L×0.2mol/L×5}{1}$=0.02mol.
所以8g产品中Fe2+的质量0.02mol×56g/mol=1.12g,所以8g产品中Fe2+的质量分数为$\frac{1.12g}{8g}$×100%=14%.
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;14%.
点评 本题以莫尔盐的制备为载体,考察盐类水解、氧化还原反应、氧化还原反应滴定应用、物质分离提纯等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,注意基础知识的全面掌握.

 阅读快车系列答案
阅读快车系列答案①金属 ②非金属 ③酸 ④碱 ⑤酸性氧化物 ⑥碱性氧化物.
| A. | 只有③④ | B. | 只有①② | C. | 只有①③⑤ | D. | 全部 |
| 1.0 MPa | 2.0 MPa | 3.0 MPa | |
| 800℃ | a | b | 83% |
| 900℃ | c | 75% | d |
| 1000℃ | 54% | e | f |
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
| A. | Li2NH中N的化合价是-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | 每有1molLi2NH参加反应,则有2mol电子转移 | |
| D. | 该反应中H2既是氧化剂,又是还原剂 |
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 维生素C具有还原性,在人体内起抗氧化作用 |
已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
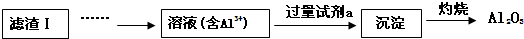
(2)滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式)
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
(5)磷酸亚铁锂电池总反应为:FePO4+Li $?_{充电}^{放电}$ LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:FePO4+Li++e-=LiFePO4.若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况、产生时,该电池消耗锂的质量为1.4g.
| A. | 过滤 | B. | 用分液漏斗分液 | ||
| C. | 通入足量CO2后,过滤 | D. | 加入适量NaOH溶液,反应后再分液 |
| A. | H | B. | Mg | C. | O | D. | F |