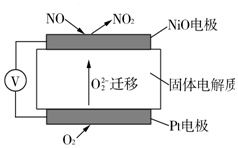
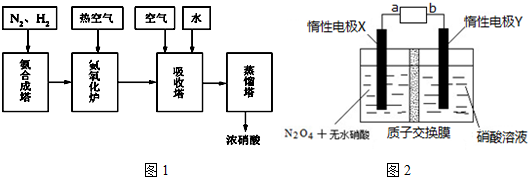
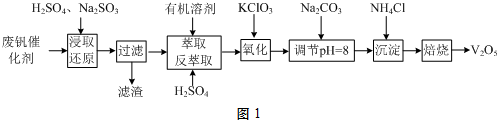
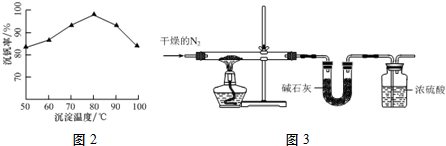
题目内容
1.在中和滴定中,下列操作或说法不正确的是( )| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液 | |
| C. | 盛放准确量取待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定操作应重复2至3次,并求出滴定用去的溶液体积的平均值,计算出待测液的浓度 |
分析 A.使用滴定管时,必须润洗,否则浓度变小;
B.二氧化硅与碱性溶液反应生成硅酸钠具有粘性,酸性溶液或强氧化性溶液可氧化腐蚀橡胶;
C.锥形瓶不需要润洗;
D.滴定实验为了减小误差,应应重复2至3次,并求出滴定用去的溶液体积的平均值.
解答 解:A.因滴定管装液时,防止试剂被稀释,洗涤后必须用待装液润洗2~3次,故A正确;
B.二氧化硅与碱性溶液反应生成硅酸钠具有粘性,酸性溶液或强氧化性溶液可氧化腐蚀橡胶,则酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液或强氧化性溶液,故B正确;
C.因盛装待测液的锥形瓶无需用待测液润洗,否则待测液的量增多,影响测定结果,故C错误;
D.滴定实验为了减小误差,应应重复2至3次,并求出滴定用去的溶液体积的平均值,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握中和滴定实验为解答的关键,侧重分析与实验能力的考查,注意实验的基本操作和实验技能,题目难度中等.

练习册系列答案
相关题目
12.实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验.请完成下列填空:
(1)配制100mL 0.10mol•L-1 NaOH标准溶液.称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol•L-1(保留两位有效数字).
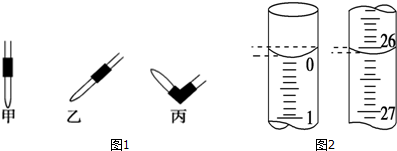
③排去碱式滴定管中气泡的方法应采用如图1所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④若滴定开始和结束时,碱式滴定管中的液面如图2所示,则起始读数为0.00 mL,终点读数为26.10 mL;所用NaOH溶液的体积为26.10 mL.
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有DE(填字母序号).
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
(1)配制100mL 0.10mol•L-1 NaOH标准溶液.称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol•L-1(保留两位有效数字).

③排去碱式滴定管中气泡的方法应采用如图1所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④若滴定开始和结束时,碱式滴定管中的液面如图2所示,则起始读数为0.00 mL,终点读数为26.10 mL;所用NaOH溶液的体积为26.10 mL.
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有DE(填字母序号).
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
13.图是炭和水蒸汽发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应.下列说法不正确的是( )


| A. | 步骤1为吸热反应,步骤2为放热反应 | |
| B. | E2>E3>E1 | |
| C. | 1mol C发生该反应时吸收的能量为E3-E1 | |
| D. | E2-E1<E2-E3 |
10.能正确表示下列反应的离子方程式为( )
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
11. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
(1)表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,△H<0(填“>”、“<”或“=”).
②300℃下,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,判断反应正向(填“正向”或“逆向”)进行.
③要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
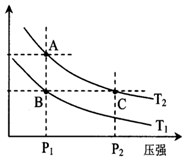
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(3)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)═2CO2(g) K2
③H2O(g)═H2O(l) K3
④CH3OH(l)+O2(g)═CO(g)+2H2O(l) K4
则K4=$\frac{{{K}_{1}}^{\frac{1}{2}}{{K}_{3}}^{2}}{{K}_{2}\frac{1}{2}}$(用含有K1,K2,K3的代数式表达).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)(1)表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃下,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,判断反应正向(填“正向”或“逆向”)进行.
③要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(3)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)═2CO2(g) K2
③H2O(g)═H2O(l) K3
④CH3OH(l)+O2(g)═CO(g)+2H2O(l) K4
则K4=$\frac{{{K}_{1}}^{\frac{1}{2}}{{K}_{3}}^{2}}{{K}_{2}\frac{1}{2}}$(用含有K1,K2,K3的代数式表达).