题目内容
6.化合物A(C8H10),用高锰酸钾氧化时生成二元羧酸B(C8H6O4),B的一硝基取代物只有一种,试推测A、B的构造式.分析 与苯环相连的碳上有氢原子能被高锰酸钾氧化,据此解题.
解答 解:与苯环相连的碳上有氢原子能被高锰酸钾氧化,B的一硝基取代物只有一种,说明为对位结构;A、B分别为 ;
; ,故答案为:
,故答案为: ;
; .
.
点评 本题考查有机物的推断,注意根据转化关系进行推断,掌握官能团的性质与转化是关键,难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
14.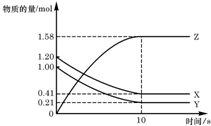 一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
 一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到 10s,用 Z 表示的反应速率为 0.158mol/(L•s) | |
| B. | 反应开始到 10s,X 的物质的量浓度减少了 0.79mol/L | |
| C. | 反应开始到 10s,Y 的转化率为 79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
1.化学反应A2+B2=2AB的能量变化如图所示.下列说法正确的是( )
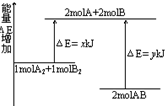

| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1molB-B键共可放出xKJ能量 | |
| C. | 断裂1molA-B键需要吸收yKJ能量 | |
| D. | 1molA2和1molB2完全反应生产2molAB,放出(y-x)KJ能量 |
11.等质量下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
| A. | Fe2O3 | B. | FeSO4 | C. | Cu | D. | CuO |
4.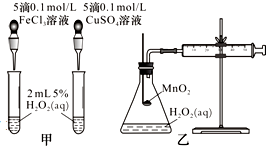 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略).
①实验1、2研究的是温度对H2O2分解速率的影响.
②实验2、3的目的是比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异.
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是控制阴离子相同,排除阴离子的干扰.
②定量分析:如图乙所示,实验时以收集到40mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是收集40mL气体所需时间.
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快.对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是放热反应,导致溶液温度升高,反应速率加快;
②从影响化学反应速率的因素看,你认为还可能是催化剂(Mn2+的催化作用)的影响.要证明你的猜想,实验方案是用两组酸性高锰酸钾溶液和草酸溶液作对比实验,一组加入少量MnSO4固体,一组不加,看反应速率快慢.
 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 |
①实验1、2研究的是温度对H2O2分解速率的影响.
②实验2、3的目的是比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异.
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是控制阴离子相同,排除阴离子的干扰.
②定量分析:如图乙所示,实验时以收集到40mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是收集40mL气体所需时间.
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快.对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是放热反应,导致溶液温度升高,反应速率加快;
②从影响化学反应速率的因素看,你认为还可能是催化剂(Mn2+的催化作用)的影响.要证明你的猜想,实验方案是用两组酸性高锰酸钾溶液和草酸溶液作对比实验,一组加入少量MnSO4固体,一组不加,看反应速率快慢.
1.下列对一些实验事实的理论解释错误的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2的熔点高于CH4 | 碳氧键键能大于碳氢键 |
| C | H2O的沸点高于H2S | H2O分子间形成了氢键 |
| D | 金刚石的硬度大于晶体硅 | 碳碳键键能大于硅硅键 |
| A. | A | B. | B | C. | C | D. | D |
2.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| B. | 金属钠、电石着火时,直接用高压水枪喷水扑灭 | |
| C. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| D. | 家庭中洁厕灵与“84消毒液”不能同时使用 |