题目内容
 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.探究一:(1)实验方案:铝镁合金
| NaOH溶液 |
(2)实验步骤:
①称取5.4g铝镁合金粉末样品,投入盛有V mL 2.0mol?L-1NaOH溶液的烧杯中,充分反应,要想达到预期实验目的,则NaOH溶液的体积V≥
②过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
探究二:实验方案:铝镁合金
| 盐酸 |
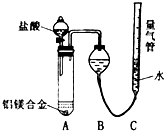
实验步骤:①连接好实验装置(如图)并检查气密性;
②在A试管中加入5.4g镁铝合金,逐滴滴入稀盐酸至不再产生气体;
③冷却并恢复至室温;
④调节量气管C的高度,使B、C装置中液面持平后平视读数,量气管内
液体上升的体积即生成的气体体积,V(气体)=6496mL.(已换算成标况)
(3)合金中镁的质量分数=
(4)如果没有步骤③,测得镁的质量分数将
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(2)①镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
②镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
(3)可以依据合金与盐酸反应生成的氢气,测定氢气体积来计算镁和铝的质量,得到镁的质量分数;
(4)如果没有步骤③,冷却并恢复至室温,测定气体体积会增大,结合计算过程分析判断,测得镁的质量分数将减小.
(2)①镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
②镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
(3)可以依据合金与盐酸反应生成的氢气,测定氢气体积来计算镁和铝的质量,得到镁的质量分数;
(4)如果没有步骤③,冷却并恢复至室温,测定气体体积会增大,结合计算过程分析判断,测得镁的质量分数将减小.
解答:
解:(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)①含镁为3%时,金属铝的含量最高,5.4g合金中铝的质量为,5.4g×(1-3%)=5.4×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
5.4g×97% V×10-3L×2.0mol/L
所以54g:(5.4g×97%)=2mol:(V×10-3L×2.0mol/L),解得:V=97,故V(NaOH溶液)≥97mL,故答案为:97mL;
②镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,故答案为:偏高;
(3)依据合金与盐酸反应生成的氢气,测定氢气体积来计算铝和镁的质量得到镁的质量分数,设镁物质的量为x,铝物质的量为y,
24x+27y=5.4g
x+1.5y=
=0.29
x=0.03mol
y=0.173mol
镁的质量分数=
×100%=13.3%,
故答案为:13.3;
(4)依据上述技术可知,如果没有步骤③,气体体积增大,计算得到铝物质的量增大,镁物质的量减小,所以测定镁的质量分数偏低,故答案为:偏低.
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)①含镁为3%时,金属铝的含量最高,5.4g合金中铝的质量为,5.4g×(1-3%)=5.4×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
5.4g×97% V×10-3L×2.0mol/L
所以54g:(5.4g×97%)=2mol:(V×10-3L×2.0mol/L),解得:V=97,故V(NaOH溶液)≥97mL,故答案为:97mL;
②镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,故答案为:偏高;
(3)依据合金与盐酸反应生成的氢气,测定氢气体积来计算铝和镁的质量得到镁的质量分数,设镁物质的量为x,铝物质的量为y,
24x+27y=5.4g
x+1.5y=
| 6.496L |
| 22.4/mol |
x=0.03mol
y=0.173mol
镁的质量分数=
| 0.03mol×24g×/mol |
| 5.4g |
故答案为:13.3;
(4)依据上述技术可知,如果没有步骤③,气体体积增大,计算得到铝物质的量增大,镁物质的量减小,所以测定镁的质量分数偏低,故答案为:偏低.
点评:本题主要考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

练习册系列答案
相关题目
下列实验操作中错误的是( )
| A、蒸发操作时,当出现大量晶体是,才能停止加热,用余热加热 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,应选择有机萃取剂,萃取剂的密度应比水大 |
关于下列四个图象的说法中正确的是( ) 

| A、图①t1时改变的条件可能是升高了温度或增大了压强 |
| B、图②该微粒仅为18O2-不能为16O2- |
| C、图③若A为CaO,则B可能为MgO |
| D、图④中的△H1<△H2 |
下列说法中正确的是( )
| A、电解精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、金属氧化物均为碱性氧化物 |
| C、Na2O2与水发生反应时,Na2O2作氧化剂,水作还原剂 |
| D、自行车钢架生锈主要是电化学腐蚀 |
一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志是( )
| A、N2、H2和NH3的物质的量分数不再改变 |
| B、c(N2):c(H2):c(NH3)=1:3:2 |
| C、单位时间每增加1molN2,同时增加2mol NH3 |
| D、N2与H2的物质的量之和是NH3的2倍 |
电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是:Zn+2OH--2e-═ZnO+H2O; Ag2O+H2O+2e-═2Ag+2OH- 下列说法正确的是( )
| A、Zn为正极,Ag2O为负极 |
| B、Ag2O发生还原反应 |
| C、原电池工作时,正极区溶液pH值减小 |
| D、原电池工作时,负极区溶液pH值增大 |
下列氯化物中,能直接利用对应的金属单质与稀盐酸反应得到的是( )
| A、FeCl3 |
| B、CuCl2 |
| C、AgCl |
| D、AlCl3 |