题目内容
某元素的同位素
X,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值为 ,A值为 ;
(2)X元素在周期表中的位置 X的离子结构示意图为 .
A Z |
(1)Z值为
(2)X元素在周期表中的位置
考点:质量数与质子数、中子数之间的相互关系
专题:原子组成与结构专题
分析:(1)根据Cl-+Ag+═AgCl↓计算XCl2的物质的量,再由M=
计算其摩尔质量,摩尔质量与相对分子质量的数值相等,原子的质量数为原子的近似相对原子质量,结合该原子原子核内有20个中子,根据质子数=质量数-中子数来计算原子的质子数;
(2)利用质子数确定元素在周期表中的位置,根据X的核外电子排布画出离子结构示意图.
| m |
| n |
(2)利用质子数确定元素在周期表中的位置,根据X的核外电子排布画出离子结构示意图.
解答:
解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
n(XCl2)=
n(Cl-)=
×0.02mol=0.01mol,
则M(XCl2)=
=111g/mol,
所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,
质子数=质量数-中子数=40-20=20,则Z=20,A=40;
故答案为:20;40;
(2)质子数为20,则X为Ca,位于第四周期第ⅡA族,Ca2+的核电核数为20,原子核外有18个电子,Ca2+的原子结构示意图为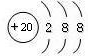 ,
,
故答案为:X位于第四周期第ⅡA族; .
.
n(XCl2)=
| 1 |
| 2 |
| 1 |
| 2 |
则M(XCl2)=
| 1.11g |
| 0.01mol |
所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,
质子数=质量数-中子数=40-20=20,则Z=20,A=40;
故答案为:20;40;
(2)质子数为20,则X为Ca,位于第四周期第ⅡA族,Ca2+的核电核数为20,原子核外有18个电子,Ca2+的原子结构示意图为
 ,
,故答案为:X位于第四周期第ⅡA族;
 .
.
点评:本题考查利用离子反应方程式的计算及确定元素在元素周期表中的位置、单质的性质等,题目难度不大,熟悉离子之间的关系、原子中的数量关系即可解答.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、将40g NaOH溶解于1L水中,得到1mol?L-1的NaOH溶液 |
| B、将11.2L HCl气体通入水中配成0.5L溶液,浓度为1mol?L-1 |
| C、将1L 10 mol?L-1的盐酸与9L水混合,混合液浓度为1mol?L-1 |
| D、10g NaOH溶解在水中配成250mL溶液,其浓度为1mol?L-1 |
下列关于电解质溶液的叙述正确的是 ( )
| A、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | ||
| B、在pH=3 的溶液中,Na+、Cl-、Fe2+、ClO-可以大量共存 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | ||
D、向0.1mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
 有如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
有如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.