题目内容
 (1)在一定条件下,容积为 100L密闭容器中发生反应:
(1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
将1.0mol CH4和2.0mol H2O(g)通入该密闭容器 l0min时有0.1mol CO生成,则10min内该反应的平均速率υ(H2)
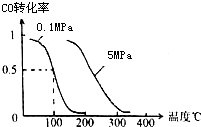
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g) 平衡时CO的转化率与温度、压强的关系如图.
①该反应的△H
②100℃时该反应的平衡常数K=
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率
④在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的
考点:转化率随温度、压强的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据v=
计算v(CO),再利用速率之比等于化学计量数之比计算v(H2);
(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动;
②平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值,平衡常数k=
,根据CO的转化率,利用三段式计算出平衡时各组分的物质的量,进而求出平衡时各组分的浓度,代入平衡常数计算;
③温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动;平衡常数只受温度影响,温度不变,平衡常数不变;
④计算参加反应的CO的物质的量,利用差量法计算平衡时反应混合物的物质的量变化量,进而计算平衡时总的物质的量,利用恒温恒容下,压强之比等于物质的量之比解答.
| △c |
| △t |
(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动;
②平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值,平衡常数k=
| c(CH3OH) |
| c(CO)?c3(H2) |
③温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动;平衡常数只受温度影响,温度不变,平衡常数不变;
④计算参加反应的CO的物质的量,利用差量法计算平衡时反应混合物的物质的量变化量,进而计算平衡时总的物质的量,利用恒温恒容下,压强之比等于物质的量之比解答.
解答:
解:(1)l0min时有0.1mol CO生成,所以v(CO)=
=0.0001 mo1?L-1?min-1.速率之比等于化学计量数之比,所以v(H2)=3v(CO)=3×0.0001 mo1?L-1?min-1=0.0003 mo1?L-1?min-1,
故答案为:0.0003 mo1?L-1?min-1;
(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,所以正反应为放热反应,即△H<0.故答案为:<;
②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
对于反应 CO(g)+2H2(g)?CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a 0.5a
平衡(mol):0.5a a 0.5a
所以平衡时 CO的浓度为
=
mol/L,H2的浓度为
=
mol/L,CH3OH的浓度为
mol/L.
100℃时该反应的平衡常数k=
=
=
,
故答案为:
;
③温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大.平衡常数只受温度影响,温度不变,平衡常数不变.
故答案为:增大;不变;
④参加反应的CO的物质的量为2.5mol×90%=2.25mol,则:
CO(g)+2H2(g)?CH3OH(g) 物质的量减少△n
1 2
2.25mol 4.5mol
故平衡时总的物质的量为2.5mol+7.5mol-4.5mol=5.5mol,恒温恒容下压强之比等于物质的量之比,故平衡时容器内压强为开始时压强的
=0.55倍,
故答案为:0.55.
| ||
| 10min |
故答案为:0.0003 mo1?L-1?min-1;
(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,所以正反应为放热反应,即△H<0.故答案为:<;
②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
对于反应 CO(g)+2H2(g)?CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a 0.5a
平衡(mol):0.5a a 0.5a
所以平衡时 CO的浓度为
| 0.5a |
| VL |
| a |
| 2V |
| amol |
| VL |
| a |
| V |
| a |
| 2V |
100℃时该反应的平衡常数k=
| c(CH3OH) |
| c(CO)?c3(H2) |
| ||||
|
| V2 |
| a2 |
故答案为:
| V2 |
| a2 |
③温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大.平衡常数只受温度影响,温度不变,平衡常数不变.
故答案为:增大;不变;
④参加反应的CO的物质的量为2.5mol×90%=2.25mol,则:
CO(g)+2H2(g)?CH3OH(g) 物质的量减少△n
1 2
2.25mol 4.5mol
故平衡时总的物质的量为2.5mol+7.5mol-4.5mol=5.5mol,恒温恒容下压强之比等于物质的量之比,故平衡时容器内压强为开始时压强的
| 5.5mol |
| 2.5mol+7.5mol |
故答案为:0.55.
点评:本题考查化学平衡图象、化学平衡有关计算、化学平衡常数、影响化学平衡的因素、热化学方程式书写,是对知识的综合运用,应加强平时知识的积累,难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
下列反应中属于氧化还原反应的是( )
| A、SO3+H2O=H2SO4 | ||||
| B、CaCO3+2HCl=CaCl2+H2O+CO2↑ | ||||
| C、Cl2+H2O=HCl+HClO | ||||
D、2NaHCO3
|
关于氯气及氯水的叙述中,下列正确的是( )
| A、纯净的氯气是一种黄绿色、有毒的气体,具有漂白性 |
| B、可用干燥的石蕊试纸验证氯水是否变质 |
| C、氯气能与铁反应,液氯不宜贮存在钢瓶中 |
| D、氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物 |
下列叙述正确的是( )
| A、将40g NaOH溶解于1L水中,得到1mol?L-1的NaOH溶液 |
| B、将11.2L HCl气体通入水中配成0.5L溶液,浓度为1mol?L-1 |
| C、将1L 10 mol?L-1的盐酸与9L水混合,混合液浓度为1mol?L-1 |
| D、10g NaOH溶解在水中配成250mL溶液,其浓度为1mol?L-1 |
 )具有
)具有
 转化为
转化为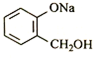 ,则应加入
,则应加入