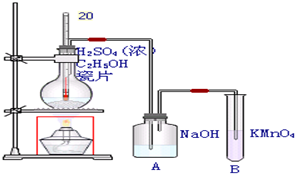
题目内容
9.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与S2-的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )| A. | 原子半径:Z>Y>X | |
| B. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| C. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
分析 X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与S2-的核外电子数相等,3种元素的核外电子数之和为18,Z得到1个电子变成稀有气体的8电子结构,则Z为F元素,则X、Y一定至少有一种位于第2周期,X得到一个电子后均形成稀有气体原子的稳定电子层结构,故X为H元素,Y元素原子核外电子数为18-1-9=8,故Y为O元素,结合选项解答.
解答 解:X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与S2-的核外电子数相等,3种元素的核外电子数之和为18,Z得到1个电子变成稀有气体的8电子结构,则Z为F元素,则X、Y一定至少有一种位于第2周期,X得到一个电子后均形成稀有气体原子的稳定电子层结构,故X为H元素,Y元素原子核外电子数为18-1-9=8,故Y为O元素.
A.X、Y、Z分别是H、O、F,同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径O>F>H,故A错误;
B.CaO2与水反应生成氢氧化钙与氧气,过氧化钙既是氧化剂又是还原剂,故B错误;
C.HF分子之间含有氢键,沸点高于其它同族氢化物的沸点,故C正确;
D.CaH2和CaF2中阴离子分别为H-、F-,阳离子与阴离子的个数比均为1:2,但CaO2中阴离子为O22-,阳离子与阴离子个数比为1:1,故D错误.
故选C.
点评 本题考查结构性质位置关系、氧化还原反应等,难度中等,推断元素是解题关键,B选项中根据过氧化钠与水反应解答.

练习册系列答案
相关题目
19.下列化学实验事实及其解释或结论都正确的是( )
| A. | 蘸有浓氨水的玻璃棒置于某浓无机酸的试剂瓶口,有大量白烟,说明该酸为盐酸 | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再滴入有机物X,加热至沸后无砖红色沉淀,说明X中不含有醛基 | |
| C. | 向KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有还原性 | |
| D. | 往盛有漂粉精溶液的试管中滴加浓硫酸,产生黄绿色气体,说明浓硫酸有强氧化性 |
20.已知HCN是直线型结构,下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. | CH2═CH-CN | B. | CH2═CH-CH═CH2 | C. |  | D. |  |
17.下列各项中表达正确的是考( )
| A. | CO2的电子式为: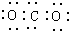 | B. | Cl2的结构式: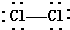 | ||
| C. | 用电子式表示NaCl的形成过程: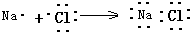 | D. | F-的结构示意图: |
4.下列实验现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将20mL2mol/L的NaOH溶液缓缓地倒入20mL2mol/L的盐酸中,边加边搅拌,测定反应前后溶液温度的变化 | 温度升高 | 释放出的热量就是中和热 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小段镁带和一小块铝分别放在同体积、同浓度的盐酸中 | 都有气泡产生,镁带产生气泡更快 | 镁比铝活泼 |
| D | 将少量氯气通入到NaBr溶液中 | 溶液变成橙红色 | 氯气溶于水呈现橙红色 |
| A. | A | B. | B | C. | C□D.D |
1.下列说法正确的是( )
| A. | 氯气不可用于自来水的消毒 | B. | 镁可用于制造信号弹和焰火 | ||
| C. | 氢氧化铁胶体不能用于净水 | D. | 二氧化硫不可用于漂白纸浆 |
18.在稀溶液在,2ROH(aq)+H2SO4(aq)═R2SO4(aq)+2H2O(l)△H=-24.6 kJ•mol-1,又知稀硫酸与NaOH溶液反应时的中和热为57.3 kJ•mol-1,则ROH(aq)═OH-(aq)+R+(aq)的△H为( )
| A. | +45 kJ•mol-1 | B. | +32.7 kJ•mol-1 | C. | -45 kJ•mol-1 | D. | 无法计算 |
9.黄酮类化合物具有抗肿瘤活性,如图为合成中间体之一,下列有关该物质的说法正确的是( )
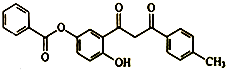

| A. | 分子中含醚键,不含手性碳原子 | |
| B. | 在空气中易被氧化变质 | |
| C. | 能发生取代、加成、消去反应 | |
| D. | 1mol该物质最多能与3mol NaOH溶液发生反应 |