题目内容
1.下列说法正确的是( )| A. | 氯气不可用于自来水的消毒 | B. | 镁可用于制造信号弹和焰火 | ||
| C. | 氢氧化铁胶体不能用于净水 | D. | 二氧化硫不可用于漂白纸浆 |
分析 A.氯气与水反应生成次氯酸,具有杀菌消毒作用;
B.依据镁条燃烧发出耀眼白光解答;
C.氢氧化铁胶体具有吸附性,能够吸附水中固体杂质颗粒;
D.二氧化硫能够与有机色素化合生成无色物质,具有漂白性.
解答 解:A.氯气与水反应生成次氯酸,具有杀菌消毒作用,通常在自来水中通入一定量氯气做杀菌消毒剂,故A错误;
B.镁条燃烧发出耀眼白光,可以用于制造信号弹和焰火,故B正确;
C.氢氧化铁胶体具有吸附性,能够吸附水中固体杂质颗粒,可以做净水剂,故C错误;
D.二氧化硫具有漂白性,能够漂白纸浆,故D错误;
故选:B.
点评 本题考查了元素化合物知识,侧重考查物质的用途,性质决定用途,熟悉相关物质的性质是解题关键,题目难度不大,注意积累.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
11.实验室用Al2(SO4)制取Al(OH)3,最合适的试剂是( )
| A. | NaOH | B. | H2SO4 | C. | NH3•H2O | D. | KOH |
12.下列关于碱金属元素的性质,说法不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增加而增多,原子半径逐渐增大 | |
| B. | 从上到下,对应单质的颜色随着核电荷数的增加而加深 | |
| C. | 从上到下,随着核电荷数的增加,对应单质与水反应的剧烈程度逐渐增大 | |
| D. | 从上到下,随着核电荷数的增加,对应单质的熔、沸点都逐渐减小 |
9.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与S2-的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| C. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
16.对于反应A2+3B2═2C来说,以下表示中,反应速率最快的是( )
| A. | v(B2)=0.8 mol•L-1•s-1 | B. | v(A2)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=1.8 mol•L-1•s-1 |
6.下列说法正确的是( )
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某化合物在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和HCl两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
10.下列涉及有机物的说法正确的是( )
| A. | 乙烯、氯乙烯、苯乙烯都是不饱和烃,均可用于合成有机高分子材料 | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 酒越陈越香是因为酒中含有的有机酸与乙醇生成了酯 | |
| D. | 糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物 |
1.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
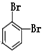 和
和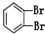 ④CH4和CH3CH2CH3; ⑤葡萄糖与果糖;⑥16O和18O.
④CH4和CH3CH2CH3; ⑤葡萄糖与果糖;⑥16O和18O.