题目内容
 烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:
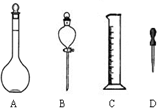
烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:(1)如图所示仪器,配制上述溶液不需用到的是
配制过程中还还缺少的玻璃仪器有
(2)实验操作过程中,应量取
(3)下列操作可能引起所配溶液浓度偏低的有
A.该学生在量取浓硫酸时,俯视刻度线
B.在混合溶液中加入浓H2SO4后没有冷却至室温就立即完成后面的配制操作.
C.容量瓶中原来存有少量蒸馏水
D.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
E.将量筒洗涤2-3次,并全部转移至容量瓶中
F.胶头滴管加水定容时俯视刻度
(4)在定容操作时,因不慎加水致凹液面最低处超过了刻度线,该如何处理:
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的和缺少的仪器;
(2)根据溶液稀释定律C浓V浓=C稀V稀来计算;
(3)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)配制过程中的操作失误,能补救就补救,不能补救就需重新配制.
(2)根据溶液稀释定律C浓V浓=C稀V稀来计算;
(3)根据c=
| m |
| M |
(4)配制过程中的操作失误,能补救就补救,不能补救就需重新配制.
解答:
解:(1)操作步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、1000mL容量瓶、胶头滴管,故不需要的仪器是B,还缺少的仪器是玻璃棒,
故答案为:B;玻璃棒;
(2)设需要加入的浓硫酸的体积为XL,水的体积为YL,根据硫酸的物质的量的守恒可知:1.6mol/L×(0.1+X+Y)L=0.16mol/L×0.1L+18mol/L×XL ①
根据硫酸钠的物质的量的守恒可知:0.2mol/L×(0.1+X+Y)L=2mol/L×0.1L ②
解①②得:X=0.088L=88mL Y=0.812L=812mL
故需要加入的浓硫酸的体积为88mL,最后溶液的体积共1000mL,故应选用1000mL容量瓶,故答案为:88;
(3)A.该学生在量取浓硫酸时,俯视刻度线,则浓硫酸的体积偏小,则配制出的溶液的浓度偏低,故A正确;
B.在混合溶液中加入浓H2SO4后没有冷却至室温就立即完成后面的配制操作,则冷却后溶液体积偏小,则浓度偏高,故B错误.
C.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故C错误;
D.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中,会导致溶质的损失,则浓度偏低,故D正确;
E.量筒的洗涤液不能注入容量瓶,如果将量筒洗涤2-3次,并全部转移至容量瓶中,则溶质的物质的量偏高,故浓度偏高,故E错误;
F.胶头滴管加水定容时俯视刻度,则溶液的体积偏小,则浓度偏高,故F错误;
故选AD.
(4)配制过程中的操作失误,能补救就补救,不能补救就需重新配制,在定容操作时,因不慎加水致凹液面最低处超过了刻度线,该失误无法补救,故应重新配制,故答案为:重新配制.
故答案为:B;玻璃棒;
(2)设需要加入的浓硫酸的体积为XL,水的体积为YL,根据硫酸的物质的量的守恒可知:1.6mol/L×(0.1+X+Y)L=0.16mol/L×0.1L+18mol/L×XL ①
根据硫酸钠的物质的量的守恒可知:0.2mol/L×(0.1+X+Y)L=2mol/L×0.1L ②
解①②得:X=0.088L=88mL Y=0.812L=812mL
故需要加入的浓硫酸的体积为88mL,最后溶液的体积共1000mL,故应选用1000mL容量瓶,故答案为:88;
(3)A.该学生在量取浓硫酸时,俯视刻度线,则浓硫酸的体积偏小,则配制出的溶液的浓度偏低,故A正确;
B.在混合溶液中加入浓H2SO4后没有冷却至室温就立即完成后面的配制操作,则冷却后溶液体积偏小,则浓度偏高,故B错误.
C.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故C错误;
D.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中,会导致溶质的损失,则浓度偏低,故D正确;
E.量筒的洗涤液不能注入容量瓶,如果将量筒洗涤2-3次,并全部转移至容量瓶中,则溶质的物质的量偏高,故浓度偏高,故E错误;
F.胶头滴管加水定容时俯视刻度,则溶液的体积偏小,则浓度偏高,故F错误;
故选AD.
(4)配制过程中的操作失误,能补救就补救,不能补救就需重新配制,在定容操作时,因不慎加水致凹液面最低处超过了刻度线,该失误无法补救,故应重新配制,故答案为:重新配制.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
下列实验方法能达到目的是( )
| A、用氨水清洗试管内壁附着的银镜 |
| B、将NH4Cl溶液蒸干制备NH4Cl固体 |
| C、制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| D、可用K3[Fe(CN)6]溶液鉴定FeCl3溶液中是否存在Fe2+ |
下列各项叙述中,正确的是( )
| A、钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量 |
| B、价电子排布为4s24p3的元素位于第四周期第ⅢA族 |
| C、2p和3p轨道形状均为哑铃状,能量也相等 |
| D、在现代化学中,常利用原子光谱上的特征谱线来鉴定元素 |
实验室要用98%的浓硫酸(密度为1.84g?ml-1)配制0.5mol?L-1硫酸溶液480ml,选用的主要仪器有烧杯、胶头滴管、玻璃棒、量筒,还缺少( )
| A、容量瓶 |
| B、250ml容量瓶 |
| C、分液漏斗 |
| D、500ml容量瓶 |
配制一定物质的量浓度的NaOH溶液,下列叙述正确的是( )
| A、称量时,将NaOH固体直接放在托盘天平的左盘上 |
| B、将NaOH固体在烧杯中溶解后立即转移至容量瓶中 |
| C、定容时,俯视容量瓶的刻度线会使所配溶液的浓度偏高 |
| D、定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
铁及其合金在生产、生活中应用广泛,下列说法中正确的是( )
| A、生铁中含有碳,抗腐蚀能力比纯铁强 |
| B、铁与盐溶液所发生的反应都是置换反应 |
| C、铁与稀硫酸反应,铁与浓硫酸不能反应 |
| D、工业上可以用铝热反应的方法制取少量的铁 |
工业炼铁用到的原料有铁矿石、焦炭、空气、石灰石等,下列对原料在冶炼过程中的作用叙述不正确的是( )
| A、焦炭是铁矿石炼铁时的还原剂 |
| B、焦炭先与空气中的氧气反应,为炼铁提供能量 |
| C、石灰石是助矿石中杂质形成炉渣 |
| D、固体原料需粉碎,增大与气体的接触面 |
 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题: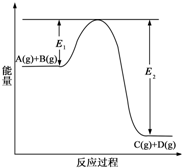 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.