题目内容
水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)
、Pb(OH)
,各形态的浓度分数α随溶液pH变化的关系如图所示:1表示PB2+,2表示PB(OH)+,3表示PB(OH)2,4表示Pb(OH)
,5表示Pb(OH)
.
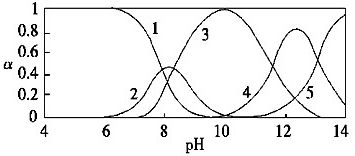
(1)Pb(NO3)2溶液中,
2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
增加,可能的原因是 .
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有 ,pH=9时主要反应的离子方程式为 .
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如表:
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是 .
(4)如果该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+?E2Pb(s)+2H+则脱铅的最合适pH范围为
A.4~5 B.6~7 C.9~10 D.11~12.
- 3 |
2- 4 |
- 3 |
2- 4 |

(1)Pb(NO3)2溶液中,
c(N
| ||
| c(Pb2+) |
c(N
| ||
| c(Pb2+) |
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如表:
| 离 子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg?L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg?L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
(4)如果该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+?E2Pb(s)+2H+则脱铅的最合适pH范围为
A.4~5 B.6~7 C.9~10 D.11~12.
考点:难溶电解质的溶解平衡及沉淀转化的本质,物质分离和提纯的方法和基本操作综合应用
专题:电离平衡与溶液的pH专题
分析:(1)因为Pb(NO3)2是一种强酸弱碱盐,Pb2+发生水解,使c(Pb2+)减小;滴入硫酸铵溶液生成PbSO4沉淀,使Pb2+浓度降低;
(2)pH=9时,曲线2、3表示的物质共存,由图可知Pb(OH)2的浓度分数比Pb(OH)+的大,所以主要反应是生成Pb(OH)2,pH=12时,Pb(OH)3-、Pb(OH)42-共存;
(3)根据浓度变化判断处理效果;
(4)根据反应判断,参加反应的是Pb2+,由图象可知,选择PH要使铅全部以Pb2+形式存在.
(2)pH=9时,曲线2、3表示的物质共存,由图可知Pb(OH)2的浓度分数比Pb(OH)+的大,所以主要反应是生成Pb(OH)2,pH=12时,Pb(OH)3-、Pb(OH)42-共存;
(3)根据浓度变化判断处理效果;
(4)根据反应判断,参加反应的是Pb2+,由图象可知,选择PH要使铅全部以Pb2+形式存在.
解答:
解:(1)因为Pb(NO3)2是一种强酸弱碱盐,在水溶液中存在如下水解平衡:2H2O+Pb2+?Pb(OH)2+2H+,使c(Pb2+)减小,所以
>2,往该溶液中滴入硫酸铵溶液后,发生Pb2++SO42-═PbSO4↓,使Pb2+浓度降低,则
增加;
故答案为:>;Pb2+与Cl-反应,Pb2+浓度减少;
(2)由图象可知pH=8时,Pb2+,Pb(OH)+和Pb(OH)2共存,另外溶液中还有H+,所以中存在的阳离子(Na+除外)有Pb2+、Pb(OH)+、H+;pH=9时,曲线2、3表示的物质共存,由图可知Pb(OH)2的浓度分数比Pb(OH)+的大,所以主要反应是生成Pb(OH)2,反应的方程式为Pb2++2OH-═Pb(OH)2↓;
故答案为:Pb2+、Pb(OH)+、H+;Pb2++2OH-═Pb(OH)2↓;
(3)加入脱铅剂,Pb2+浓度转化率为
=96%,Fe3+浓度转化率为
=67%,而其它两种离子转化率较小,则除Pb2+外,该脱铅剂对其它离子的去除效果最好的是Fe3+,
故答案为:Fe3+;
(4)反应为2EH(s)+Pb2+?E2Pb(s)+2H+,参加反应的是Pb2+,由图象可知,选择PH要使铅全部以Pb2+形式存在,应为6~7之间,
故答案为:B.
| c(NO3-) |
| c(Pb2+) |
| c(NO3-) |
| c(Pb2+) |
故答案为:>;Pb2+与Cl-反应,Pb2+浓度减少;
(2)由图象可知pH=8时,Pb2+,Pb(OH)+和Pb(OH)2共存,另外溶液中还有H+,所以中存在的阳离子(Na+除外)有Pb2+、Pb(OH)+、H+;pH=9时,曲线2、3表示的物质共存,由图可知Pb(OH)2的浓度分数比Pb(OH)+的大,所以主要反应是生成Pb(OH)2,反应的方程式为Pb2++2OH-═Pb(OH)2↓;
故答案为:Pb2+、Pb(OH)+、H+;Pb2++2OH-═Pb(OH)2↓;
(3)加入脱铅剂,Pb2+浓度转化率为
| 0.1-0.004 |
| 0.1 |
| 0.12-0.04 |
| 0.12 |
故答案为:Fe3+;
(4)反应为2EH(s)+Pb2+?E2Pb(s)+2H+,参加反应的是Pb2+,由图象可知,选择PH要使铅全部以Pb2+形式存在,应为6~7之间,
故答案为:B.
点评:本题以Pb2+在水溶液中的各种形态与溶液中pH变化关系图,考查了学生在对多重平衡的函数曲线理解,是一个典型的利用多元信息,综合性考查学生知识与能力的创新型题目,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向碳酸氢镁溶液中逐滴加入澄清石灰水,下列离子反应可能发生的是( )
| A、Mg2++2OH-→Mg(OH)2↓ |
| B、Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O |
| C、Mg2++HCO3-+Ca2++3OH-→Mg(OH)2↓+CaCO3↓+H2O |
| D、Mg2++4HCO3-+2Ca2++4OH-→2MgCO3↓+2CaCO3↓+4H2O |
 主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是( )
主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是( )| A、n=2 |
| B、A是第ⅡA族元素 |
| C、A为-2价,B为+2价 |
| D、该离子没有还原性 |
 25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A、曲线Ⅰ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D、曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |