题目内容
9.根据下列标准,分类合理的是( )| A. | 根据物质的组成元素是否单一,将纯净物分为单质和化合物 | |
| B. | 根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 | |
| C. | 根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 | |
| D. | 根据变化过程中是否有化学键的断裂,将物质变化分为物理变化和化学变化 |
分析 A.单质是由一种元素组成的纯净物,化合物是由不同种元素组成的纯净物;
B.氧化还原反应的特征是元素化合价变化;
C.电解质水溶液中电离程度分为强电解质和弱电解质;
D.化学反应的实质是旧键断裂,新键形成的过程,有新物质生产,无新物质生成的变化为物理变化.
解答 解:A.物质的分类中,根据物质的组成元素是否单一,将纯净物分为单质和化合物,故A正确;
B.根据反应中的元素化合价的变化,将化学反应分为氧化还原反应、非氧化还原反应,故B错误;
C.电解质水溶液中完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质,溶液导电能力强弱和离子浓度大小有关,故C错误;
D.只有旧键断裂的变化不是化学变化,过程中是否有新物质生成将物质变化分为物理变化和化学变化,故D错误;
故选A.
点评 本题考查了物质分类、物质组成、物质性质,注意变化过程的实质理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.关于化学对社会进步和人类文明的贡献,下列说法不正确的是( )
| A. | 化石燃料的直接利用,促进了低碳经济的发展 | |
| B. | 新材料的研制和应用,提高了人们的生活品质 | |
| C. | 合成药物的研发和使用,促进了医疗卫生事业的发展 | |
| D. | 化肥的合理使用提高了农作物产量,缓解了人类粮食危机 |
17.实验室中需要配制2mol/L的NaOH溶液850mL,配制时应选用的容量瓶的规格和称取的NaOH的质量分别是( )
| A. | 950 mL,76 g | B. | 500 mL,80 g | C. | 1000 mL,80 g | D. | 1000 mL,76 g |
4.第四周期过渡元素常与H2O、NH3、CN-等形成配合物.
(1)Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,形成配位数为6的配合物,写出该配合物的化学式K4[Fe(CN)6].
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为do或d10排布时,无颜色;为d1一d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).[Mn(H2O)6]2+配离子中存在的化学键有CD (填标号)
A.金属键 B.离子键 C.共价键 D.配位键
(3)H2S和H2O2的主要物理性质比较如表:
①H2O2分子中O原子采取sp3杂化,写出H2O2的电子式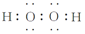
②H2S和H2O2的相对分子质量相同,造成沸点差异的主要原因是H2O2分子间形成氢键;造成溶解度差异的主要原因是H2O2分子与H2O分子间形成氢键.
(1)Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,形成配位数为6的配合物,写出该配合物的化学式K4[Fe(CN)6].
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为do或d10排布时,无颜色;为d1一d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).[Mn(H2O)6]2+配离子中存在的化学键有CD (填标号)
A.金属键 B.离子键 C.共价键 D.配位键
(3)H2S和H2O2的主要物理性质比较如表:
| 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 202 | 2.6 |
| H2O2 | 423 | 以任意比互溶 |
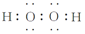
②H2S和H2O2的相对分子质量相同,造成沸点差异的主要原因是H2O2分子间形成氢键;造成溶解度差异的主要原因是H2O2分子与H2O分子间形成氢键.
14.a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )
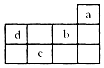

| A. | a原子最外电子层上的电子数为8 | |
| B. | b的最高价氧化物对应水化物为强酸 | |
| C. | c存在的两种常见氧化物分子组成上相差一个氧原子 | |
| D. | d和b都是第二周期的非金属元素,且d比b的非金属性强 |
1.图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
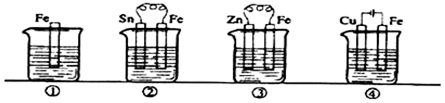

| A. | ③>②>④>① | B. | ④>②>①>③ | C. | ②>①>③>④ | D. | ④>②>③>① |
12.下列反应属于氧化还原反应的是( )
| A. | CO2+H2O=H2CO3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO | ||
| C. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$NaCl |
