题目内容
1.图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
| A. | ③>②>④>① | B. | ④>②>①>③ | C. | ②>①>③>④ | D. | ④>②>③>① |
分析 先判断装置是原电池还是电解池,再根据原电池正负极腐蚀的快慢和电解池的阴阳极腐蚀快慢来比较,从而确定腐蚀快慢顺序,电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,②③装置是原电池,在③中锌比铁活泼,金属铁做正极,②中金属铁比锡活泼,所以铁作负极,而①发生化学腐蚀,速率较慢,做负极的腐蚀速率快,所以②>①>③,④装置是电解池,其中金属铁为阳极,腐蚀速率最快,所以腐蚀速率是④>②>①>③,
故选B.
点评 本题考查了金属腐蚀快慢判断,为高频考点,明确铁发生的腐蚀类型及作何种电极即可解答,利用金属腐蚀与防护,采取合适措施防止铁被腐蚀,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
11.科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-.下列叙述错误的是( )

| A. | c电极是正极,发生还原反应 | |
| B. | B口通入的是甲烷,发生氧化反应 | |
| C. | 放电时O2-离子向d极移动 | |
| D. | d极上的电极反应式为:CH4+4O2-+8e-=CO2↑+2H2O |
9.根据下列标准,分类合理的是( )
| A. | 根据物质的组成元素是否单一,将纯净物分为单质和化合物 | |
| B. | 根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 | |
| C. | 根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 | |
| D. | 根据变化过程中是否有化学键的断裂,将物质变化分为物理变化和化学变化 |
4.下列转化必须加入还原剂才能实现的是( )
| A. | Fe3+→Fe2+ | B. | Zn→Zn2+ | C. | H2→H2O | D. | Cl2→Cl- |
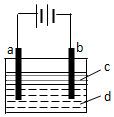 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.