题目内容
1.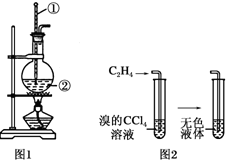 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH $→_{170℃}^{浓硫酸}$ CH2═CH2↑+H2O,回答下列问题:
(1)图1中仪器①、②的名称分别为温度计、圆底烧瓶.
(2)收集乙烯气体最好的方法是排水集气法.
(3)向溴的四氯化碳溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于加成反应(填反应类型),反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
分析 乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯,乙烯不溶于水,密度与空气相近,可用排水法收集,乙烯含有碳碳双键,可发生加成反应,可使溴的四氯化碳溶液褪色,以此解答该题.
解答 解:(1)图1中仪器①用于测量反应温度,名称为温度计;仪器②由于盛放乙醇和浓硫酸的混合液,名称为圆底烧瓶,
故答案为:温度计;圆底烧瓶;
(2)乙烯的密度与空气密度接近,不能使用排空气法收集,乙烯不溶于水,可以用排水法收集乙烯,
故答案为:排水集气法;
(3)向溴的四氯化碳溶液中通入乙烯(如图2),乙烯与溴发生加成反应生成1,2-二溴乙烷,所以溶液的颜色很快褪去,反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:加成反应;CH2=CH2+Br2→CH2BrCH2Br.
点评 本题主要考查了乙烯的实验室制法以及性质的检验,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意掌握常见仪器的干燥及使用方法,明确乙烯的实验室制法及反应原理.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
11.NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.3NA | |
| B. | 4.48L氨气分子中含有0.6NA个N-H键 | |
| C. | 铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 4℃时,18g2H216O中含有共用电子对数为2NA |
12.如图所示,甲装置可直接除去城市废水中的尿素,既能产生净化的水,又能发电.乙装置可用于人工肾脏间接电化学方法除去代谢产物中的尿素的工作原理.

下列关于描述正确的是( )

下列关于描述正确的是( )
| A. | 甲乙装置连接是a接c、b接d | |
| B. | 甲装置工作时H+ 移向负极 | |
| C. | 乙装置阴极室溶液的pH与电解前相比将升高 | |
| D. | a和c电极都发生CO(NH2)2-6e-+H2O═N2↑+CO2↑+6H+ |
9.请你观察下列几个装置示意图,有关叙述正确的是( )
| A. |  装置中阳极上析出红色固体 | B. |  装置中铜片应与电源负极相连 | ||
| C. |  装置中外电路电流方向:b极→a极 | D. |  装中阴极反应:2Cl--2e-═Cl2↑ |
6.下列属于放热反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ | |
| C. | C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2 | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
10.下列叙述正确的是( )
| A. | 同周期元素的原子半径以ⅤⅡA族的为最大 | |
| B. | 同主族元素两种元素原子的核外电子数的差值可能为26 | |
| C. | 短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| D. | 同周期第ⅡA族和ⅢA族元素的原子序数之差不可能为25 |
2.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1 mol H2O2分子中含极性共价键数目为0.3NA |
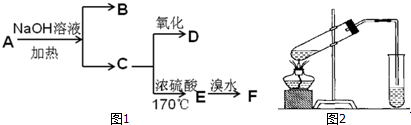
 ,反应类型氧化反应;
,反应类型氧化反应; ,反应类型加聚反应.
,反应类型加聚反应.