题目内容
11.NA为阿伏加德罗常数,下列有关说法正确的是( )| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.3NA | |
| B. | 4.48L氨气分子中含有0.6NA个N-H键 | |
| C. | 铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 4℃时,18g2H216O中含有共用电子对数为2NA |
分析 A.过氧化钠的化学式中含有2个钠离子、1个过氧根离子;
B.没有指出在标准状况下,不能使用标准状况下的气体摩尔体积计算;
C.该原电池中,铁失去电子生成亚铁离子;
D.18g 2H216O的物质的量为0.9mol,然后根据 2H216O中含2对共用电子对来分析.
解答 解:A.7.8g过氧化钠的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,故A正确;
B.不是标准状况下,不能使用标准状况下的气体摩尔体积计算氨气的物质的量,故B错误;
C.5.6g铁的物质的量为0.1mol,0.1mol铁失去0.2mol电子生成0.1mol亚铁离子,则流过外电路的电子为0.2NA,故C错误;
D.18g 2H216O的物质的量为0.9mol,而 2H216O中含2对共用电子对,故0.9mol中含1.8NA对共用电子对,故D错误;
故选
点评 本题考查阿物质的量的计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
8.下列实验操作或实验现象与预期实验目的或所得实验结论一致的是( )
| 选项 | 实 验 操 作 | 实验目的或结论 |
| A | 向某溶液中加入几滴氯水后再滴入KSCN溶液,溶液变红 | 该溶液中一定含Fe2+ |
| B | 将吸有NaOH溶液的长胶头滴管伸入盛有FeSO4溶液的试管底部并缓慢挤出碱液 | 防止加碱过程中带入空气,制备并较长时间观察到白色絮状的Fe(OH)2沉淀 |
| C | 蒸馏实验操作时将温度计插入液面以下但不能触碰到烧瓶内壁 | 准确测定馏分的温度,以便于液体混合物分离 |
| D | Fe(OH)3胶体的电泳实验中发现阴极附近颜色加深而阳极附近颜色变浅 | 说明Fe(OH)3胶体带正电荷 |
| A. | A | B. | B | C. | C | D. | D |
19.已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量.下列说法正确的是( )
| A. | 电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 | |
| B. | 水分解产生氢气和氧气时放出能量 | |
| C. | 相同状况下,反应2CO+O2═2CO2是一个放热反应,则反应2CO2═2CO+O2是一个吸热反应 | |
| D. | 氯化氢分解成氢气和氯气时需要吸收能量,实验氯化氢的总能量高于氢气和氯气的总能量 |
6.下列操作:
①用氢气除去乙烷中含有的乙烯;
②用酸性高锰酸钾溶液除去苯中含有的甲苯;
③用氢氧化钠溶液除去溴苯中含有的Br2;
④用水鉴别甲苯和溴乙烷;
⑤用溴的四氯化碳溶液鉴别苯和己烷.
①~⑤中不能达到实验目的有( )
①用氢气除去乙烷中含有的乙烯;
②用酸性高锰酸钾溶液除去苯中含有的甲苯;
③用氢氧化钠溶液除去溴苯中含有的Br2;
④用水鉴别甲苯和溴乙烷;
⑤用溴的四氯化碳溶液鉴别苯和己烷.
①~⑤中不能达到实验目的有( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
16.煤化工中两个重要反应为①C(s)+H2O(g)?H2(g)+CO(g)
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
①实验Ⅰ中,从反应开始到反应达到平衡时,H2O(g)的平均反应速率为0.16mol•L-1•min-1.
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验 组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
 HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.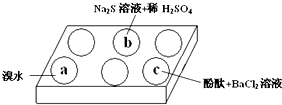
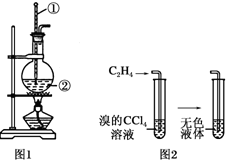 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为: