题目内容
2.NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1 mol H2O2分子中含极性共价键数目为0.3NA |
分析 A、求出 CaO2的物质的量,然后根据CaO2由钙离子和过氧根构成来分析;
B、反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol转移6mol电子;
C、溶液体积不明确;
D、H2O2分子中含2个极性共价键.
解答 解:A、7.2gCaO2晶体的物质的量n=$\frac{m}{M}$=$\frac{7.2g}{72g/mol}$=0.1mol,而CaO2晶体中含1个钙离子和1个过氧根离子,故0.1molCaO2中含0.2mol离子,故A错误;
B、反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol转移6mol电子,放出热量9.2 kJ时,转移电子0.6 NA,故B正确;
C、溶液体积不明确,故无法计算氯离子数目,故C错误;
D、H2O2分子中含2个极性共价键,故0.1 mol H2O2分子中含极性共价键数目为0.2 NA,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用、物质的状态和物质的结构是关键,题目难度不大.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 相同温度下,0.6mol/L氨水溶液与0.3mol/L氨水溶液中c(OH-)之比是2:1 | |
| B. | 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) | |
| C. | 25℃时,10mL 0.02mol•L-1HCl溶液与10mL0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 | |
| D. | 25℃时pH=10的NaOH溶液与60℃时pH=10的NaClO溶液中:c(H+)相等 |
10.下列递变规律不正确的是( )
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | C、N、O原子半径依次增大 | D. | P、S、Cl最高正价依次升高 |
17.下列热化学方程式中△H的数值能表示可燃物燃烧热的是( )
| A. | CO(g)+$\frac{1}{2}$O2 (g)═CO2(g)△H=-283 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-802.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O (l)△H=-571.6 kJ/mol | |
| D. | H2 (g)+Cl2 (g)═2HCl (g)△H=-184.6 kJ/mol |
7.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g) 达平衡的标志是( )
| A. | v正(N2)=v逆(N2) | B. | v正(N2)=3v正(H2) | ||
| C. | v正(H2)=3 v逆(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
11.实验室用如图所示装置制备AlCl3溶液,并用AlCl3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备新型的超导材料和发光材料七铝十二钙 (12CaO•7Al2O3).已知AlCl3易水解,易升华.
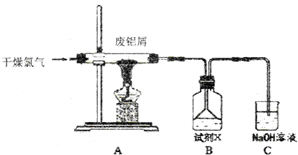
(1)①实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为ClO3-+5Cl-+6H+=3Cl2+3H2O;
②C装置的作用吸收氯气,防止污染空气;
(2)氯气与废铝屑反应生成的AlCl3蒸气溶解在B中,B中盛放的试剂X是盐酸;为了防止AlCl3蒸气凝华堵塞导管,实验中可采取的措施是加粗导管、缩短导管长度、加热导管、通入氮气等(写出一点).
(3)B装置中的AlCl3溶液溶解CaCO3时,AlCl3溶液和碳酸钙粉末的混合方式为碳酸钙粉末慢慢加入到AlCl3溶液中;
(4)实验要控制碳酸钙和AlCl3的量,要求n(CaCO3):n(AlCl3)>12:14,其原因是氢氧化钙微溶于水,造成损失;
(5)以工业碳酸钙(含有少量Al2O3、Fe2O3杂质)生产二水合氯化钙(CaCl2•2H2O)的方法为:将工业碳酸钙溶于盐酸,向溶液中加入氢氧化钙,搅拌,用pH计调节溶液的pH≤4.7,过滤,向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤,冰水洗涤,干燥.
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
(实验中需用到的试剂和仪器有:盐酸,氢氧化钙,冰水,pH计).

(1)①实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为ClO3-+5Cl-+6H+=3Cl2+3H2O;
②C装置的作用吸收氯气,防止污染空气;
(2)氯气与废铝屑反应生成的AlCl3蒸气溶解在B中,B中盛放的试剂X是盐酸;为了防止AlCl3蒸气凝华堵塞导管,实验中可采取的措施是加粗导管、缩短导管长度、加热导管、通入氮气等(写出一点).
(3)B装置中的AlCl3溶液溶解CaCO3时,AlCl3溶液和碳酸钙粉末的混合方式为碳酸钙粉末慢慢加入到AlCl3溶液中;
(4)实验要控制碳酸钙和AlCl3的量,要求n(CaCO3):n(AlCl3)>12:14,其原因是氢氧化钙微溶于水,造成损失;
(5)以工业碳酸钙(含有少量Al2O3、Fe2O3杂质)生产二水合氯化钙(CaCl2•2H2O)的方法为:将工业碳酸钙溶于盐酸,向溶液中加入氢氧化钙,搅拌,用pH计调节溶液的pH≤4.7,过滤,向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤,冰水洗涤,干燥.
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
12.下列各元素,最高正化合价数最大的是( )
| A. | O | B. | Al | C. | F | D. | S |
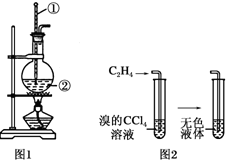 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为: