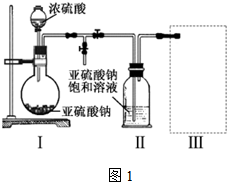
题目内容
12.亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2?LiNH2+LiH,下列有关说法正确的是( )| A. | Li2NH中N的化合价是-1 | B. | LiH的电子式为Li+:H- | ||
| C. | 该反应中H2既是氧化剂又是还原剂 | D. | LiNH2是还原产物,LiH是氧化产物 |
分析 根据反应Li2NH+H2→LiNH2+LiH可知:Li2NH中N的化合价为-3价,H为+1价,LiNH2中N的化合价为-3价,H为+1价,LiH中H的化合价为-1价,反应中H2既是氧化剂又是还原剂,据此结合氧化还原反应特征进行判断.
解答 解:A.Li2NH中N的化合价为-3价,故A错误;
B.H-为阴离子,电子式中需要标出最外层电子,LiH正确的电子式为,Li+[H:]-,故B错误;
C.该反应中氢气中的氢原子部分失电子化合价升高,部分得电子化合价降低,所以氢气既是氧化剂又是还原剂,故C正确;
D.LiNH2中H为+1价,H元素化合价升高,为氧化产物,LiH中H为-1价,化合价降低被还原,为还原产物,故D错误;
故选C.
点评 本题考查考查氧化还原反应,题目难度不大,注意从化合价的角度分析氧化还原反应,解答的关键是正确分析各元素的化合价,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.短周期元素形成的两种简单离子X+、Y2-,下列有关说法正确的是( )
| A. | X、Y元素的主族序数之差为1 | |
| B. | 若X+、Y2-相差两个电子层,则X2Y可能是离子化合物也可能是共价化合物 | |
| C. | 若X+、Y2-核外电子数相差8,则原子半径Y>X | |
| D. | 若X+、Y2-具有相同的电子层结构,则离子半径X+>Y2- |
3.汽车排气管加装催化装置,可有效减少CO和的排放.催化装置内发生反应为:NOx+CO$\stackrel{催化剂}{→}$N2+CO2(未配平),下列关于此反应的说法中不正确的是( )
| A. | 上述氧化物都是酸性氧化物 | |
| B. | 该反应中NOx用作氧化剂,发生还原反应 | |
| C. | 当x=2时,每生成1molN2,转移电子数为4mol | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
20.下列表述正确的是( )
| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式 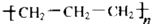 | ||
| C. | 四氯化碳分子的电子式 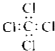 | D. | 丙烷分子的球棍模型  |
7.从海水中可以提取溴,主要反应为2Br-+Cl2═Br2+2Cl-,下列说法中正确的是( )
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于取代反应 | D. | 氯气的氧化性比溴单质强 |
17.下列关于化学变化的叙述错误的是( )
| A. | 化学变化一定伴随能量变化 | |
| B. | 化学变化一定有化学键的断裂和生成 | |
| C. | 化学变化一定放热 | |
| D. | 化学变化一定有新物质生成 |