题目内容
1.将11.2L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g.求原气体混合物中乙烯与乙烷的物质的量之比和质量比.分析 乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,即为乙烯的质量.根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算物质的量、质量关系.
解答 解:11.2L混合气体的物质的量为n=$\frac{V}{{V}_{m}}$=$\frac{11.2L}{22.4L/mol}$=0.5mol,
乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,即为乙烯的质量,
所以乙烯的物质的量为n=$\frac{m}{M}$=$\frac{5.6g}{28g/mol}$=0.2mol,
则乙烷的物质的量为:0.5mol-0.2mol=0.3mol,质量为:0.3mol×30g/mol=9g,
所以,乙烯与乙烷的物质的量之比为0.2mol:0.3mol=2:3,
质量之比为5.6g:9g=28:45,
答:原气体混合物中乙烯与乙烷的物质的量之比和质量比分别为2:3、28:45.
点评 本题考查物质的量的相关计算,题目难度不大,注意乙烯与乙烷的性质差别.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
11.实验室里钠保存在下列哪种液体中( )
| A. | 煤油 | B. | 水 | C. | 苯 | D. | 四氯化碳 |
12.亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2?LiNH2+LiH,下列有关说法正确的是( )
| A. | Li2NH中N的化合价是-1 | B. | LiH的电子式为Li+:H- | ||
| C. | 该反应中H2既是氧化剂又是还原剂 | D. | LiNH2是还原产物,LiH是氧化产物 |
9.J、L、R、T是原子序数依次增大的短周期主族元素,其中J、R、T在周期表中的相对位置如右表:J元素最外层电子数是电子层数的2倍.L与R同周期,且L在该周期中原子半径最大.
(1)R 2-的离子结构示意图为 .
.
(2)写出L元素与T元索组成化合物的电子式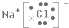 .
.
(3)写出实验室制备单质T2的离子反应方程式MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)单质T2与石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)单质L与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,放出热量215kJ.则该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1.
| J | ||||
| R | T |
 .
.(2)写出L元素与T元索组成化合物的电子式
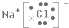 .
.(3)写出实验室制备单质T2的离子反应方程式MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)单质T2与石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)单质L与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,放出热量215kJ.则该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1.
6.莽草酸 是从烹调香料“八角”提取的一种有机物,是合成抗禽流感药物的基本原料,1mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为( )
是从烹调香料“八角”提取的一种有机物,是合成抗禽流感药物的基本原料,1mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为( )
 是从烹调香料“八角”提取的一种有机物,是合成抗禽流感药物的基本原料,1mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为( )
是从烹调香料“八角”提取的一种有机物,是合成抗禽流感药物的基本原料,1mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为( )| A. | 4:1 | B. | 1:1 | C. | 3:1 | D. | 1:4 |
9.下列有关物质的量的说法,错误的是( )
| A. | 1摩尔任何气体都含有6.02×1023个分子 | |
| B. | 0.012Kg12C中含有6.02×1023个碳原子 | |
| C. | 1摩尔水中含有2mol氢和1mol氧 | |
| D. | 1molH2O中含有3 mol原子 |