题目内容
17.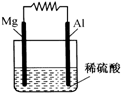 如图所示.
如图所示.(1)写出正极的电极反应式:2H++2e-=H2↑.
(2)电子的流向:Mg流向Al.
(3)若将稀硫酸换成KOH溶液,则电流的方向为Mg流向Al.
分析 (1)Mg、Al、稀硫酸构成的原电池中,Mg易失电子作负极,Al作正极,正极上氢离子得电子发生还原反应;
(2)电子从负极流向正极;
(3)若将稀硫酸换成KOH溶液,Al易失电子作负极,Mg作正极,电流的方向为正极流向负极.
解答 解:(1)Mg、Al、稀硫酸构成的原电池中,Mg易失电子作负极,Al作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑;故答案为:2H++2e-=H2↑;
(2)电子从负极流向正极,则为Mg流向Al,故答案为:Mg流向Al;
(3)若将稀硫酸换成KOH溶液,Al易失电子作负极,Mg作正极,电流的方向为正极Mg流向负极Al,
故答案为:Mg流向Al.
点评 本题考查了原电池原理,根据电极上得失电子来确定正负极,难度不大,注意电解质溶液对电极的判断影响.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
14.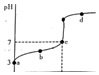 R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
 R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A. | a点表示溶液中c(CH3COO-)-定为10-3 mol/L | |
| B. | b点表示的溶液中c(Na+)<c(CH3COO-) | |
| C. | c点表示CH3COOH和NaOH恰好反应完全 | |
| D. | d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$大于K |
8.工业上用铁屑还原法制备碘化钠的主要流程如图:
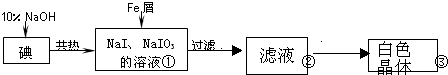
(1)碘元素位于周期表中第五周期,第ⅦA族;
(2)反应①的化学方程式3I2+6NaOH═5NaI+NaIO3+3H2O;
(3)判断反应①中碘是否已完全反应的操作是取少量反应液于试管中,向试管加入几滴淀粉溶液,若溶液变蓝,说明还未反应完,若无现象,说明已完全反应;
(4)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,采取的措施最好是隔绝空气;
(5)某同推测步骤③中得到的白色晶体是NaI、NaIO3和NaOH的混合物,设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性.
限选试剂:1mol/LH2SO4,2mol/LHNO3、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
要得到更纯的NaI,还需进一步的操作是重结晶(填操作名称)

(1)碘元素位于周期表中第五周期,第ⅦA族;
(2)反应①的化学方程式3I2+6NaOH═5NaI+NaIO3+3H2O;
(3)判断反应①中碘是否已完全反应的操作是取少量反应液于试管中,向试管加入几滴淀粉溶液,若溶液变蓝,说明还未反应完,若无现象,说明已完全反应;
(4)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,采取的措施最好是隔绝空气;
(5)某同推测步骤③中得到的白色晶体是NaI、NaIO3和NaOH的混合物,设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性.
限选试剂:1mol/LH2SO4,2mol/LHNO3、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | / |
| 取少量溶液液于试管A中,加入足量的1mol/LH2SO4. | 溶液显蓝色 | 溶液中含IO3- |
| 另取少量溶液液于试管B中,滴入几滴酚酞溶液. | 溶液变红. | 溶液中含大量0H- |
5.下列物质能将品红氧化使品红溶液褪色的是( )
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤漂白粉.
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤漂白粉.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
12.下列有关化学用语使用正确的是( )
| A. | S2-的结构示意图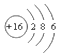 | B. | NH3结构式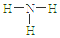 | C. | CO2的电子式: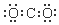 | D. | HCl电子式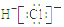 |
2.已知乙烷的燃烧热为1190KJ/mol,则下列表述正确的是( )
| A. | 2C2H6(g)+7O2 (g)=4CO2 (g)+6H2O(l);△H=-1190KJ/mol | |
| B. | C2H6(g)+$\frac{7}{2}$O2 (g)=2CO2 (g)+3H2O(g);△H=-1190KJ/mol | |
| C. | 298k、101kPa时,30g乙烷气体完全燃烧生成CO2气体和液态水,放出1190kJ热量 | |
| D. | 该反应中,反应物所具有的总能量小于生成物所具有的总能量 |
9.三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA+HB- (少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC.则三种酸对应的电离平衡常数分别为(请填空)
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小是:A.
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$c(CH3COOH) C.c(H+)•c(OH-)D.$\frac{c(O{H}^{-})}{({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$c(CH3COOH) C.c(H+)•c(OH-)D.$\frac{c(O{H}^{-})}{({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
6.下列物质中既能为人体提供热量,又能提供必需脂肪酸的物质是( )
| A. | 油脂 | B. | 维生素C | C. | 铁元素 | D. | 维生素A |
7.在溶液中能共存,加入H+能放出气体的是( )
| A. | Ag+ H+ NO3- Cl- | B. | Ca2+ NO3- HCO3- Cl- | ||
| C. | K+ H+ Cl- SO42- | D. | Ca2+ Cl-SO42- CO32- |