题目内容
下列离子方程式改写成化学方程式正确的是( )
| A、Cu2++2OH-=Cu(OH)2 CuCO3+2NaOH=Cu(OH)2+Na2CO3 |
| B、CO32-+2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
| C、Ca2++CO32-=CaCO3 Ca(NO3)2+Na2CO3=CaCO3+NaNO3 |
| D、H++OH-=H2O 2KOH+H2SO4=K2SO4+2H2O |
考点:化学方程式的书写
专题:
分析:A.碳酸铜属于沉淀不能拆;
B.碳酸钡属于沉淀不能拆;
C.离子方程式、化学方程式都应标沉淀符号;
D.H++OH-=H2O 表示强酸和强碱反应生成盐和水的反应.
B.碳酸钡属于沉淀不能拆;
C.离子方程式、化学方程式都应标沉淀符号;
D.H++OH-=H2O 表示强酸和强碱反应生成盐和水的反应.
解答:
解:A.碳酸铜是难溶物,不可拆分,应选用可溶性的铜盐,CuCl2+2NaOH=Cu(OH)2↓+2NaCl,故A错误;
B.BaCO3是难溶物,不可拆分,应选用可溶性的碳酸盐:Na2CO3+2HCl=2NaCl+CO2↑+H2O,故B错误;
C.碳酸钙为沉淀,离子方程式、化学方程式都应标注沉淀符号,故C错误;
D.2KOH+H2SO4=K2SO4+2H2O为强酸和强碱反应生成盐和水,可以用H++OH-=H2O 表示,故D正确;
故选:D.
B.BaCO3是难溶物,不可拆分,应选用可溶性的碳酸盐:Na2CO3+2HCl=2NaCl+CO2↑+H2O,故B错误;
C.碳酸钙为沉淀,离子方程式、化学方程式都应标注沉淀符号,故C错误;
D.2KOH+H2SO4=K2SO4+2H2O为强酸和强碱反应生成盐和水,可以用H++OH-=H2O 表示,故D正确;
故选:D.
点评:本题考查离子方程式的书写,题目难度不大,明确离子方程式的意义,注意化学式的拆分、原子个数守恒、电荷守恒以及反应必须符合客观事实.

练习册系列答案
相关题目
下列比较中,正确的是( )
| A、相同条件下,HF比HCN易电离,则NaF溶液的pH比NaCN溶液的大 |
| B、0.2 mol?L-1NH4Cl和0.1 mol?L-1 NaOH溶液等体积混合后:c(NH)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③NH3?H2O、④CH3COONH4,c(NH)由大到小的顺序是:②>①>④>③ |
下列说法正确的是( )
| A、两种烃相对分子质量相同,但结构不同,则它们一定是同分异构体 |
| B、有机物和无机物之间不可能出现同分异构体 |
| C、有机物若互为同分异构体,则它们一定不互为同系物 |
| D、两种有机物所含碳元素的质量分数相同,则它们一定为同分异构体 |
下列关于元素周期表的说法正确的是( )
| A、周期表里,主族元素所在的族序数等于原子核外电子数 |
| B、周期表里,元素所在的周期序数等于原子核外电子层数 |
| C、元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共有16纵行 |
| D、X2+的核外电子数目为10,则X在第二周期第ⅡA族 |
在0.5mol H2O中( )
| A、含0.5mol H |
| B、含1个水分子 |
| C、约含6.02×1023 个氧原子 |
| D、约含3.01×1023 个水分子 |
已知热化学方程式:H2O(g)=H2(g)+
O2(g)△H=+241.8kJ/mol H2(g)+
O2(g)=H2O(1)△H=-285.8kJ/mol,当1g液态水变为水蒸气时,其热量变化是( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、放热44kJ |
| B、吸热22KJ |
| C、放热22kJ |
| D、吸热2.44KJ |
下列装置能达到实验目的是( )
A、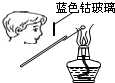 检验K2CO3中的K+ |
B、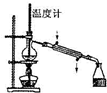 制蒸馏水 |
C、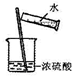 稀释浓硫酸 |
D、 除去CO的CO2 |
 碳酸氢钠是一种在生产、生活实际中有着重要用途的化合物.某课外兴趣活动小组的同学进行了以下的实验活动.
碳酸氢钠是一种在生产、生活实际中有着重要用途的化合物.某课外兴趣活动小组的同学进行了以下的实验活动.