题目内容
下列比较中,正确的是( )
| A、相同条件下,HF比HCN易电离,则NaF溶液的pH比NaCN溶液的大 |
| B、0.2 mol?L-1NH4Cl和0.1 mol?L-1 NaOH溶液等体积混合后:c(NH)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③NH3?H2O、④CH3COONH4,c(NH)由大到小的顺序是:②>①>④>③ |
考点:酸碱混合时的定性判断及有关ph的计算,影响盐类水解程度的主要因素
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.酸越易电离,其酸性越强,对应的盐的水解程度越越小,据此进行判断;
B.0.2mol/L NH4Cl和0.lmol/LNaOH溶液等体积混合,反应生成0.05mol/LNaCl、0.05mol/LNH3?H2O,还剩余0.05mol/LNH4Cl;
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合生成醋酸钠,利用电荷守恒分析;
D.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解.
B.0.2mol/L NH4Cl和0.lmol/LNaOH溶液等体积混合,反应生成0.05mol/LNaCl、0.05mol/LNH3?H2O,还剩余0.05mol/LNH4Cl;
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合生成醋酸钠,利用电荷守恒分析;
D.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解.
解答:
解:A.相同条件下,HF比HCN易电离,则酸性:HF>HCN,由于酸越弱,盐的水解程度越大,则相同浓度的NaF溶液比NaCN溶液的pH小,故A错误;
B.0.2mol/L NH4Cl和0.1mol/LNaOH溶液等体积混合,混合后溶质为0.05mol/LNaCl、0.05mol/LNH3?H2O和0.05mol/LNH4Cl,由于一水合氨的电离程度大于铵根离子的水解程度,溶液显碱性,根据溶质的浓度可知氯离子的浓度最大,则溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故B错误;
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合生成醋酸钠,由电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C正确;
D.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3?H2O,④CH3COONH4,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解,则c(NH4+)由大到小的顺序是:①>②>④>③,故D错误;
故选C.
B.0.2mol/L NH4Cl和0.1mol/LNaOH溶液等体积混合,混合后溶质为0.05mol/LNaCl、0.05mol/LNH3?H2O和0.05mol/LNH4Cl,由于一水合氨的电离程度大于铵根离子的水解程度,溶液显碱性,根据溶质的浓度可知氯离子的浓度最大,则溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故B错误;
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合生成醋酸钠,由电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C正确;
D.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3?H2O,④CH3COONH4,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解,则c(NH4+)由大到小的顺序是:①>②>④>③,故D错误;
故选C.
点评:本题考查离子浓度大小的比较,题目难度中等,注意掌握判断溶液中离子浓度大小常用方法,明确酸的强弱与盐的水解的关系、电荷守恒、水解与电离的程度及相互影响是解答本题的关键.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
一种高聚物分子B结构如图所示

B是制造优良高频电绝缘材料的树脂,它是由a、b、c 3种单体通过缩聚反应脱掉小分子H2O而生成的,则a、b、c 3种单体的结构简式依次是( )

B是制造优良高频电绝缘材料的树脂,它是由a、b、c 3种单体通过缩聚反应脱掉小分子H2O而生成的,则a、b、c 3种单体的结构简式依次是( )
A、 、HCHO和 、HCHO和 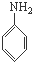 |
B、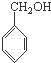 、CH3OH和 、CH3OH和 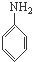 |
C、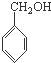 、HCHO和 、HCHO和 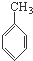 |
D、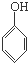 、CH3CHO和 、CH3CHO和 |
用惰性电极实现电解,下列说法正确的是( )
| A、电解稀硫酸,实质上是电解水,故溶液酸性不变 |
| B、电解池内发生的反应均为自发进行的氧化还原反应 |
| C、电解硫酸钠溶液,在阴极和阳极上析出产物的物质的量之比为1:2 |
| D、电解氯化铜溶液,在阴极和阳极上析出产物的物质的量之比为1:1 |
X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时最外层的电子排布可能是( )
| A、X:3s23p1 Y:3s23p5 |
| B、X:2s22p3 Y:2s22p5 |
| C、X:3s23p1 Y:3s23p4 |
| D、X:3s2 Y:2s22p3 |
下列物质中,含有极性键和非极性键的是( )
| A、CO2 |
| B、H2O |
| C、Br2 |
| D、H2O2 |
下列离子方程式改写成化学方程式正确的是( )
| A、Cu2++2OH-=Cu(OH)2 CuCO3+2NaOH=Cu(OH)2+Na2CO3 |
| B、CO32-+2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
| C、Ca2++CO32-=CaCO3 Ca(NO3)2+Na2CO3=CaCO3+NaNO3 |
| D、H++OH-=H2O 2KOH+H2SO4=K2SO4+2H2O |
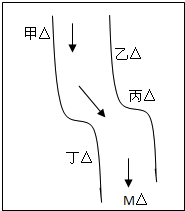 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断: