题目内容
 碳酸氢钠是一种在生产、生活实际中有着重要用途的化合物.某课外兴趣活动小组的同学进行了以下的实验活动.
碳酸氢钠是一种在生产、生活实际中有着重要用途的化合物.某课外兴趣活动小组的同学进行了以下的实验活动.(1)甲同学用如图所示的装置进行工业纯碱样品(含少量氯化钠等不与酸反应的杂质)中碳酸钠质量分数的测定.广口瓶中用碳酸氢钠饱和溶液而不用水.用饱和碳酸氢钠溶液的优点是
(2)乙同学给10℃的NaHCO3饱和溶液加热,测得该溶液的pH发生了如下的变化.请回答下列问题:
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后,冷却至50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
A.广泛pH试纸 B.pH计(酸度计)C.酚酞溶液 D.甲基橙溶液
②乙同学认为产生上述现象的原因有两种可能.预测之一是:加热时NaHCO3受热分解生成了Na2CO3;预测二是:
③查阅资料发现:NaHCO3的分解温度为150℃,由此判断,乙同学对第一种情况的预测是
(3)丙同学认为:在饱和的NaHCO3溶液中,Na+、H+、HCO3-、CO32-、OH-的离子浓度存在等量关系.c(Na+)+c(H+)=
考点:性质实验方案的设计,探究碳酸钠与碳酸氢钠的性质
专题:实验设计题
分析:(1)根据二氧化碳在碳酸氢钠饱和溶液的溶解性比在水中小分析;
(2)①根据PH值的具体数值选择;
②碳酸氢根离子水解生成碳酸和氢氧根离子,水解是吸热过程,升温HCO3-的水解程度增大,故碱性增强;
③常压下加热NaHCO3的水溶液,溶液的温度达不到150℃;NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,可利用再将热溶液冷却至30℃、20℃或10℃,看溶液的pH,从而判断预测二的正误;
(3)根据溶液中电荷守恒书写;
(2)①根据PH值的具体数值选择;
②碳酸氢根离子水解生成碳酸和氢氧根离子,水解是吸热过程,升温HCO3-的水解程度增大,故碱性增强;
③常压下加热NaHCO3的水溶液,溶液的温度达不到150℃;NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,可利用再将热溶液冷却至30℃、20℃或10℃,看溶液的pH,从而判断预测二的正误;
(3)根据溶液中电荷守恒书写;
解答:
解:(1)因为二氧化碳在碳酸氢钠饱和溶液的溶解性比在水中小,所以用饱和碳酸氢钠溶液的优点是降低二氧化碳在水中的溶解性,减小误差,故答案为:降低二氧化碳在水中的溶解性,减小误差;
(2)①根据上表中的PH值,精确到了0.1,所以应该选:B,故答案为:B;
②因为碳酸氢根离子水解生成碳酸和氢氧根离子使溶液成碱性,又水解是吸热过程,升温HCO3-的水解程度增大,故碱性增强,故答案为:水解是吸热过程,升温HCO3-的水解程度增大;
③如NaHCO3的分解温度为150℃,则乙的第一种情况的预测肯定不正确,原因是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃;在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,可利用再将热溶液冷却至30℃、20℃或10℃,看溶液的pH,从而判断预测二的正误;
故答案为:不正确;可利用再将热溶液冷却至30℃、20℃或10℃,看溶液的pH是否减小,从而判断预测二的正误;
(3)在饱和的NaHCO3溶液中,Na+、H+、HCO3-、CO32-、OH-的离子存在电荷守恒,即c(Na+)+c(H+)=C(HCO3-)+2C(CO32-)+C(OH-),故答案为:c(Na+)+c(H+)=C(HCO3-)+2C(CO32-)+C(OH-);
(2)①根据上表中的PH值,精确到了0.1,所以应该选:B,故答案为:B;
②因为碳酸氢根离子水解生成碳酸和氢氧根离子使溶液成碱性,又水解是吸热过程,升温HCO3-的水解程度增大,故碱性增强,故答案为:水解是吸热过程,升温HCO3-的水解程度增大;
③如NaHCO3的分解温度为150℃,则乙的第一种情况的预测肯定不正确,原因是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃;在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,可利用再将热溶液冷却至30℃、20℃或10℃,看溶液的pH,从而判断预测二的正误;
故答案为:不正确;可利用再将热溶液冷却至30℃、20℃或10℃,看溶液的pH是否减小,从而判断预测二的正误;
(3)在饱和的NaHCO3溶液中,Na+、H+、HCO3-、CO32-、OH-的离子存在电荷守恒,即c(Na+)+c(H+)=C(HCO3-)+2C(CO32-)+C(OH-),故答案为:c(Na+)+c(H+)=C(HCO3-)+2C(CO32-)+C(OH-);
点评:本实验将定性分析和定量考查进行了有效融合,可很好的考查分析或处理实验数据,得出合理结论以及知识迁移和再加工的能力.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
下列物质中,含有极性键和非极性键的是( )
| A、CO2 |
| B、H2O |
| C、Br2 |
| D、H2O2 |
下列离子方程式改写成化学方程式正确的是( )
| A、Cu2++2OH-=Cu(OH)2 CuCO3+2NaOH=Cu(OH)2+Na2CO3 |
| B、CO32-+2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
| C、Ca2++CO32-=CaCO3 Ca(NO3)2+Na2CO3=CaCO3+NaNO3 |
| D、H++OH-=H2O 2KOH+H2SO4=K2SO4+2H2O |
以下实验装置一般不用于分离物质的是( )
A、 |
B、 |
C、 |
D、 |
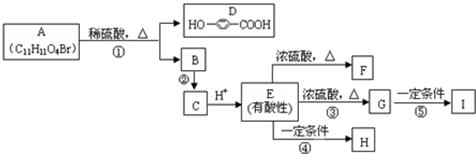
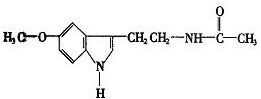 脑白金的主要作用是改善睡眠和润肠通便,主要成分是褪黑素(Melatonin)和低聚糖,其有效成分的结构简式如图,下列对该化合物的叙述正确的是( )
脑白金的主要作用是改善睡眠和润肠通便,主要成分是褪黑素(Melatonin)和低聚糖,其有效成分的结构简式如图,下列对该化合物的叙述正确的是( )