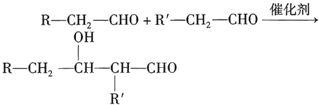
题目内容
已知热化学方程式:H2O(g)=H2(g)+
O2(g)△H=+241.8kJ/mol H2(g)+
O2(g)=H2O(1)△H=-285.8kJ/mol,当1g液态水变为水蒸气时,其热量变化是( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、放热44kJ |
| B、吸热22KJ |
| C、放热22kJ |
| D、吸热2.44KJ |
考点:有关反应热的计算
专题:
分析:根据n=
计算1g水的物质的量,依据热化学方程式和盖斯定律含义计算得到当1mol液态水变为水蒸气时的焓变,据此求得当1g液态水变为水蒸气时,其热量变化.
| m |
| M |
解答:
解:①H2O(g)=H2(g)+
O2(g)△H=+241.8kJ/mol
②H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
依据盖斯定律②+①得到H2O(g)=H2O(l)△H=-44KJ/mol
当1mol液态水变为水蒸气时H2O(l)=H2O(g)△H=+44KJ/mol,
当1mol液态水变为水蒸气时,其热量变化是吸热44KJ,1g水的物质的量的物质的量为n=
=
=
mol,所以当1g液态水变为水蒸气时,吸热
×44KJ≈2.44KJ;
故选D.
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
依据盖斯定律②+①得到H2O(g)=H2O(l)△H=-44KJ/mol
当1mol液态水变为水蒸气时H2O(l)=H2O(g)△H=+44KJ/mol,
当1mol液态水变为水蒸气时,其热量变化是吸热44KJ,1g水的物质的量的物质的量为n=
| m |
| M |
| 1g |
| 18g/mol |
| 1 |
| 18 |
| 1 |
| 18 |
故选D.
点评:本题考查了热化学方程式计算,掌握热化学方程式的意义和盖斯定律的计算应用是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时最外层的电子排布可能是( )
| A、X:3s23p1 Y:3s23p5 |
| B、X:2s22p3 Y:2s22p5 |
| C、X:3s23p1 Y:3s23p4 |
| D、X:3s2 Y:2s22p3 |
化学与科技、环境、社会生产、生活密切相关,下列有关说法不正确的是( )
| A、绿色化学的核心是利用化学原理治理环境污染 |
| B、硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 |
| C、大量使用风能、太阳能、生物质能,符合“低碳”理念 |
| D、蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
某溶液中只含Na+、Mg2+、SO42-、Cl-,其物质的量浓度比为Na+:Mg2+:Cl-=3:5:5,若Na+的浓度为3mol/L,则SO42-的浓度为( )
| A、2 mol/L |
| B、3 mol/L |
| C、4 mol/L |
| D、8 mol/L |
下列离子方程式改写成化学方程式正确的是( )
| A、Cu2++2OH-=Cu(OH)2 CuCO3+2NaOH=Cu(OH)2+Na2CO3 |
| B、CO32-+2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
| C、Ca2++CO32-=CaCO3 Ca(NO3)2+Na2CO3=CaCO3+NaNO3 |
| D、H++OH-=H2O 2KOH+H2SO4=K2SO4+2H2O |