题目内容
14.表中对离子方程式的正误判断及改正方法均正确的是( )| 选项 | 化学反应 | 离子方程式 | 判断及改正方法 |
| A | CaCO3和醋酸溶液反应 | CaCO3+2H+═Ca2++H2O+CO2↑ | 正确 |
| B | 向Ba(OH)2溶液中加H2SO4溶液 | Ba2++OH-+H++SO42-═BaSO4↓+H2O | 错误:OH-、H+、H2O的化学计量数应均为2 |
| C | 过量的浓氨水加入到AlCl3溶液中 | Al3++3NH3•H2O═3NH4++Al(OH)3↓ | 错误:应生成AlO2-、NH4+、H2O |
| D | 将铜片插入硝酸银溶液中 | Cu+Ag+═Cu2++Ag | 正确 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.氢离子、氢氧根离子的计量数错误;
C.氨水为弱碱,反应生成氢氧化铝沉淀,题中判断及修正方法错误;
D.离子方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.醋酸不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.向Ba(OH)2溶液中加H2SO4溶液,二者反应生成硫酸钡沉淀和水,OH-、H+、H2O的化学计量数应均为2,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,题中分析合理,故B正确;
C.过量的浓氨水加入到AlCl3溶液中,反应的离子方程式为:Al3++3NH3•H2O═3NH4++Al(OH)3↓,该离子方程式书写正确,题中判断及改正方法不合理,故C错误;
D.将铜片插入硝酸银溶液中,正确的离子方程式为:Cu+2Ag+═Cu2++2Ag,题中离子方程式书写不合理,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,题目难度中等,明确题干要求为解答关键,注意熟练掌握离子方程式的书写原则,试题有利于提高学生的分析能力及规范答题能力.

练习册系列答案
相关题目
5.下列各化合物的命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. | 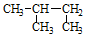 2-甲基丁烷 2-甲基丁烷 |
19.下列属于酸性氧化物的是( )
| A. | Ca(OH)2 | B. | SiO2 | C. | Na2O | D. | H2SO4 |
6.下列对有机物(结构如图)的叙述中,不正确的是( )
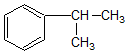

| A. | 它不能使溴水褪色也不能使酸性KMnO4溶液褪色 | |
| B. | 在FeBr3作催化剂时与Br2发生取代反应 | |
| C. | 在一定条件下可发生加成反应 | |
| D. | 一定条件下可以和浓硝酸、浓硫酸的混合物发生硝化反应 |
3.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将滴有酚酞的0.1mol•L-1氨水系稀释成0.01mol•L-1 | 溶液颜色变浅 | 稀释后NH3•H2O的电离程度减小 |
| B | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 用溴乙烷与NaOH乙醇溶液共热产生的气体通入酸性KMnO4溶液中 | 溶液褪色 | 产生的气体为乙烯 |
| D | 向1mL0.1mol•L-1 MgSO4溶液滴入2滴等浓度的NaOH溶液,片刻后再滴加2滴0.1mol•L-1 CuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的溶度积常数比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
7.往一个体积不变的密闭容器中充入H2和I2发生反应H2(g)+I2(g)?2HI(g)△H>0,当达到平衡后,t0时改变某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是( )
| A. | 容器内气体颜色变浅,平均相对分子质量不变 | |
| B. | 平衡不移动,混合气体密度增大 | |
| C. | H2的转化率增大,HI平衡浓度变小 | |
| D. | 改变条件前后,速率图象如图 |