题目内容
将稀盐酸逐滴加入Na2CO3溶液中,下列各示意图表示的混合溶液有关量的变化趋势,其中正确的是( )
A、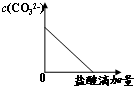 |
B、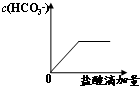 |
C、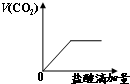 |
D、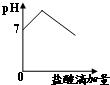 |
考点:离子方程式的有关计算,钠的重要化合物
专题:图示题
分析:将稀盐酸逐滴滴入Na2CO3溶液中,发生的反应为HCl+Na2CO3=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O,离子方程式为H++CO32-=HCO3-、HCO3-+H+=CO2↑+H2O,据此分析解答.
解答:
解:将稀盐酸逐滴滴入Na2CO3溶液中,发生的反应为HCl+Na2CO3=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O,离子方程式为H++CO32-=HCO3-、HCO3-+H+=CO2↑+H2O,
A.根据离子方程式知,溶液中CO32-浓度逐渐减小,故A正确;
B.根据离子方程式知,溶液中c(HCO3-)先增大后减小,故B错误;
C.先没有二氧化碳生成,当碳酸根离子完全转化为碳酸氢根离子后,继续滴加稀盐酸,有二氧化碳生成,故C错误;
D.先生成碳酸氢钠、氯化钠,最后生成氯化钠,所以溶液的pH一直减小,故D错误;
故选A.
A.根据离子方程式知,溶液中CO32-浓度逐渐减小,故A正确;
B.根据离子方程式知,溶液中c(HCO3-)先增大后减小,故B错误;
C.先没有二氧化碳生成,当碳酸根离子完全转化为碳酸氢根离子后,继续滴加稀盐酸,有二氧化碳生成,故C错误;
D.先生成碳酸氢钠、氯化钠,最后生成氯化钠,所以溶液的pH一直减小,故D错误;
故选A.
点评:本题考查离子方程式计算,明确物质之间的反应是解本题关键,根据方程式确定溶液中微粒浓度变化,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
以下对实验操作的说法正确的是( )
| A、由于合金中金属的活泼性不同所以合金都易生锈 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、配制FeCl3溶液时,应将FeCl3溶解在适量的HCl中 |
| D、酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测液 |
下列说法正确的是( )
| A、硼电负性和硅相近 |
| B、BCl3、PCl5、H2O三种分子的中心原子的最外层电子均不满足8e-稳定结构 |
| C、原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数 |
| D、组成和结构相似的物质随相对分子质量的增大,熔沸点升高,所以NO的沸点应该介于N2和O2之间 |
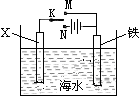 已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )| A、X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑ |
| B、X为锌棒,K置于M,外电路电流方向是从X到铁 |
| C、X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法 |
| D、X为碳棒,K置于N,在X电极周围首先失电子的是Cl- |
以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、25℃,101KPa条件下,24.5L的N2和CO混合气体含有的原子数大于2NA | ||
| B、15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA | ||
| C、1 mol SiO2中含有2 mol Si-O单键 | ||
D、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为
|
 某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.